Forschungsbericht 2012
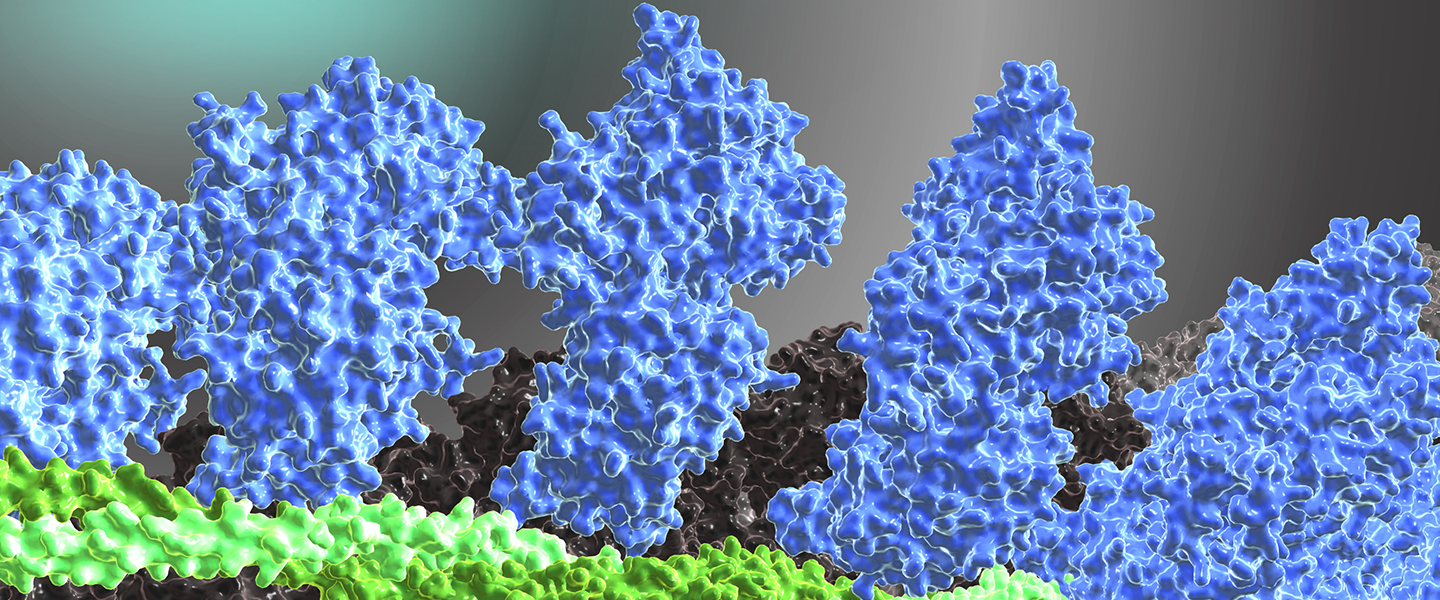
Das Titelbild des Forschungsberichtes 2012 zeigt ein computerchemisch erstelltes Strukturmodell des Aktomyosin-Tropomyosin-Komplexes (ATM-Komplex) von humanem nichtmuskulärem Myosin-2B (blau), g-Aktin (grau) und Tropomyosin (grün). Das Modell beruht auf der kürzlich experimentell gelösten Struktur eines ATM-Komplexes, der aus Myosin-1, Tropomyosin und α-Aktin besteht (Behrmann et al., Cell, 150, 327-338, 2012).
Die Modelle erlauben neue Einsichten in die Regulation der Aktomyosin-Motorfunktion durch Tropomyosin, den Mechanismus der chemomechanischen Kopplung in der Myosin-Motordomäne und bilden die Grundlage für die Entwicklung therapeutischer Ansätze zur Behandlung von Krankheiten, die durch Mutationen der kontraktilen Proteine verursacht werden.
In der zughörigen Animation wird zusätzlich die reaktive Thiolregion (SH1/SH2) in der Myosin-Motordomäne hervorgehoben, die einen Brennpunkt der allosterischen Kommunikation darstellt. Durch den kombinierten Einsatz von strukturellen, computerchemischen und biophysikalischen Methoden konnte der Mechanismus aufgeklärt werden, der zur Störung von Kraftentwicklung und ATP-Hydrolyse durch die Punktmutationen G680V und G680A führt, wobei eine Entkopplung entscheidender Strukturelemente in dieser Region stattfindet (Preller et al., J. Biol. Chem., 286, 35051-35060, 2011).
Forschungsbericht 2012
Forschungsbericht 2012
Herausgeber:
Der Forschungsdekan der Medizinischen Hochschule Hannover
Herr Prof. Dr. med. Christopher H. Baum
Bearbeitung und Ansprechpartner:
Forschungsdekanat der Medizinischen Hochschule Hannover
Petra Linke
Telefon: 0511/ 532– 6023
Fax:0511/ 532– 6024
E-Mail: linke.petra@mh-hannover.de
Gestaltung und Satz:
Digitale Medien, Medizinischen Hochschule Hannover
Joachim Barke
Telefon: 0511/ 532- 2963
Herstellung:
Digitale Medien, Medizinischen Hochschule Hannover
Telefon: 05 11/ 532– 2963
Wir danken den Mitarbeitern der Bibliothek der Medizinsichen Hochschule Hannover, Benutzungsabteilung: Frau Ingeborg Heering, für ihre Unterstützung der bibliografischen Angaben.
Wir danken den Mitarbeitern des Zentrums für Informationsmanagent (ZIMt) unter der Leitung von Herrn Dirk May für ihre Unterstützung bei der Umsetzung der IKT-gestützten Datenerhebung und der Vorbereitung des Druckprozesses.
Alle Daten (inkl. der enthaltenen Links) im Forschungsbericht beruhen auf den Angaben der jeweiligen Einrichtungen. Die Eintragung erfolgt ohne Gewähr.
Die maskuline Form aller geschlechtsspezifischen Beschreibungen gilt entsprechend für die weibliche Form.