AG – Biologische Grundlagen für Biohybridimplantate
Das muskuloskelettale System als klinisches und wissenschaftliches Handlungsfeld
Erkrankungen des muskuloskelettalen Systems besitzen höchste sozioökonomische Relevanz. So leiden heute etwa 80 % der Bevölkerung im Lauf ihres Lebens an Nacken-, Schulter- oder Rückenschmerzen. Diese Feststellung wird durch die steigende Lebenserwartung künftig noch an Brisanz gewinnen. Innovative Behandlungsansätze sind notwendig, um künftig optimale therapeutische Erfolge mit einer möglichst kurzen Rekonvaleszenzphase und dem Ergebnis einer langfristigen vollen funktionellen Wiederherstellung zu ermöglichen. Die Regenerative Medizin verspricht derartige innovative Lösungen. Insbesondere die Erfolge in der Stammzellforschung (Nobelpreis 2012) liefern hierfür zusätzliche Dynamik. Dabei sind u.a. körpereigene Stammzellen für die Forschung und gegebenenfalls für einen klinischen Einsatz verfügbar. Weitere Erfolge werden aus der Weiterentwicklung biomedizinischer Implantate resultieren. Hier konzentrieren wir uns insbesondere auf die Weiterentwicklung von muskuloskelettalen Implantaten. Die Arbeiten der Gruppe sind an der Schnittstelle zwischen Grundlagenwissenschaft und klinischer Translation angesiedelt, denn wir bringen Ergebnisse aus unserer Forschung – z. B. zu Signalwegen – in anwendungsorientierte Lösungsansätze – z. B. innerhalb einer DFG-geförderten Forschungsgruppe, siehe nachfolgend.
Beiträge zum MHH-Forschungsschwerpunkt „Transplantation, Regeneration“
Im Skelettsystem existieren als körpereigene Stammzellen die mesenchymalen Stroma- / Stammzellen (MSCs). Sie bilden neben den hämatopoetischen Stammzellen die zweite wichtige Gruppe gewebespezifischer Stammzellen und finden sich wie diese im Knochenmark, zusätzlich aber auch in verschiedenen weiteren Geweben des Körpers sowie in geburtsassoziierten Geweben. In vitro und in vivo können sie zu Zellen der mesenchymalen Linie differenziert werden: in Knochen-, Knorpel, Sehnen- und Bänder-, Fettgewebe- oder Muskelzellen. Zudem sind MSCs immunprivilegiert und besitzen immunmodulatorische (insbesondere auch immunsuppressive) Funktionen. Diese Eigenschaften beruhen im wesentlichen auf Wirkungen von löslichen Faktoren, die von MSCs abgegeben werden. MSCs sind daher medizinisch hoch relevant: Nach den hämatopoetischen Stammzellen werden sie am häufigsten in klinischen Studien und bei sehr unterschiedlichen Erkrankungen eingesetzt, unter anderem bei Abstoßungsreaktionen („graft versus host disease“) und Autoimmunerkrankungen, während Anwendungen im Skelettsystem weniger als ein Viertel aller klinischen Studien betreffen.
Somit stellen MSCs eine hoch attraktive Zellquelle dar, sowohl in grundlagenwissenschaftlicher Hinsicht als auch in der Anwendung in Biomedizinforschung und ‑technik. Die Arbeiten meiner Gruppe sollen dazu beitragen, die Bedeutung dieser Zellen für die genannten Anwendungsbereiche herauszuarbeiten und die in Forschung und Klinik erhaltenen Ergebnisse künftig aussagekräftiger, reproduzier- und vorhersagbarer zu gestalten. Dafür untersuchen wir die Funktion humaner mesenchymaler Stammzellen unter normalen und entzündlichen Bedingungen und erarbeiten neuartige Isolierungs- und Kultivierungsstrategien. Inhaltliche Schwerpunkte liegen auf dem Verständnis von Stammzellfunktionen und von Netzwerken von Signalmolekülen. Die Arbeitsgruppe RENEW-MSC der MHH konnte im vergangenen Jahr die wissenschaftlichen Ergebnisse einer gemeinsamen Forschungsarbeit in einer renommierten Fachzeitschrift, „Cytotherapy“, veröffentlichen und bietet für Studierende eine Ringvorlesung an.
Signalwege in der Regeneration: Ein molekularer Mechanismus zur Sehnenzellbildung. Genetisch modifizierte MSCs differenzierten in vitro in sehnenähnliche Zellen. Durch Implantation in vivo wurde eine zell-vermittelte Gentherapie eines segmentalen Achilles-Sehnen-Defekts der Ratte ermöglich. Nach intramuskulärer Implantation fand ektopische Sehnenbildung statt, oder es wurden sogar Sehnen-Knochen-Übergänge (Enthesen) ausgebildet. Diese Arbeiten sind zentrale Grundlage für die heutige Förderung in der DFG-Forschungsgruppe 2180 „Gradierte Implantate für Sehnen-Knochen-Verbindungen“, vgl. Kapitel „Gradierte Implantate“.
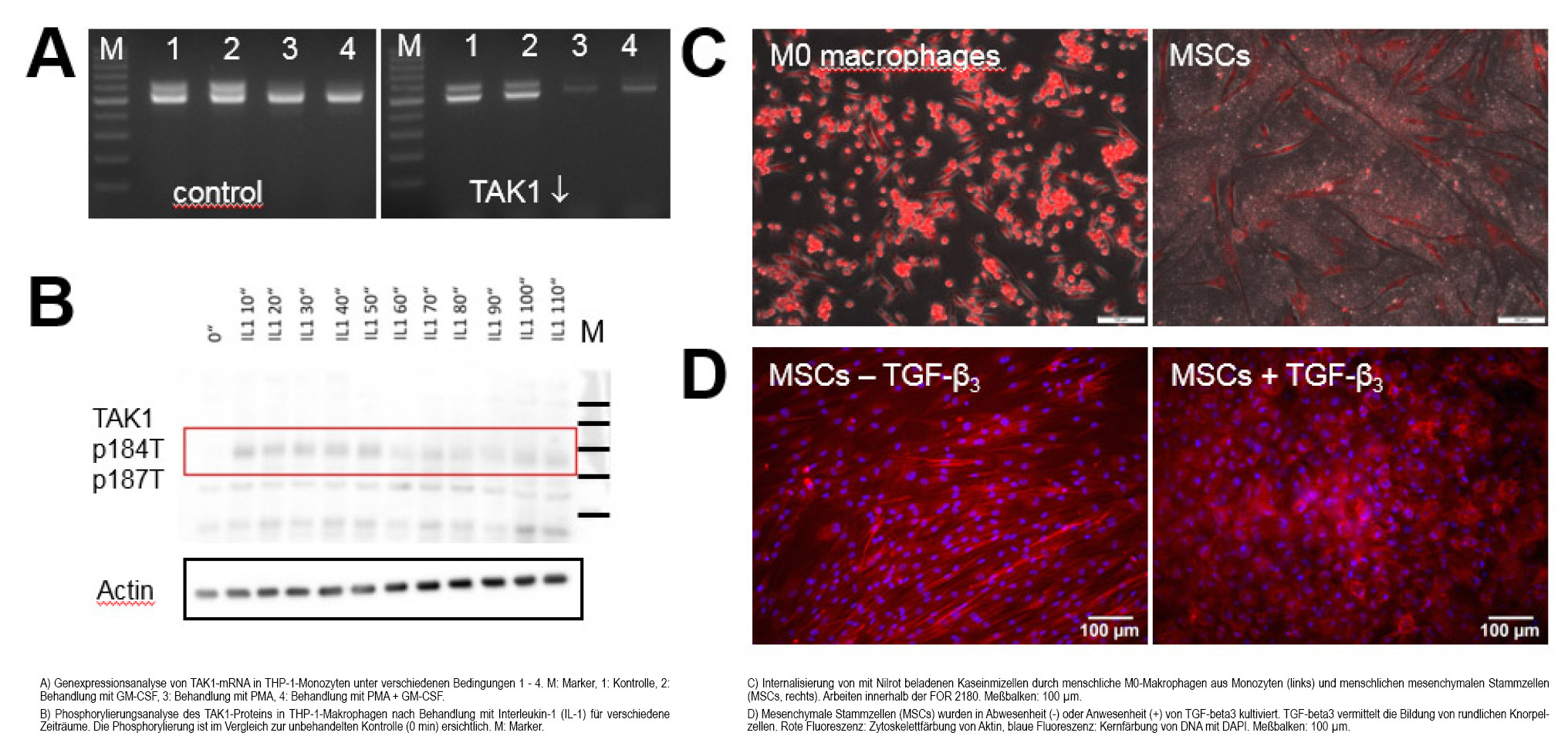
Signalwege in der Entzündung: TAK1 ist an der Entwicklung von rheumatoider Arthritis beteiligt. Die MAP3-Kinase TAK1 (Transforming Growth Factor-b Activated Kinase 1) ist ein Mitglied der mitogen-aktivierten Proteinkinase-Familie. Sie besitzt bei der Weiterleitung von Signalen der TGF-b-Wachstumsfaktoren sowie bei Infektionen und Entzündungsreaktionen integrative Funktionen. Es konnte gezeigt werden, daß TAK1 an der Entwicklung von Fibrose beteiligt ist und die Differenzierung von gewebeständigen Stammzellen sowie von Immunzellen beeinflußt. Rheumatoide Arthritis ist eine chronisch-entzündliche Erkrankung, die zu fortschreitender Gelenkzerstörung führt. Obwohl neue Biotherapien die Behandlung revolutioniert haben, besitzen diese oft Nebeneffekte, die eine weitere Entwicklung von alternativen anti-inflammatorischen Strategien notwendig machen. In einem Mausmodell (Kollagen-induzierte Arthritis in DBA/1-Mäusen) konnten wir zeigen, daß die systemische Inhibierung von TAK1 zu einer Remission der Krankheitszeichen führte. Dieser Befund könnte eine Entwicklung von anti-inflammatorischen Strategien als Alternative zu bisherigen Biotherapien ermöglichen.
Beiträge zum MHH-Forschungsschwerpunkt „Biomedizintechnik, Implantate“
Gradierte Implantate. Die biomedizinische Implantatforschung konzentriert sich bisher auf Implantate für homogen aufgebaute Gewebearten, z. B. Knochen. Weniger gut erforscht sind Implantate für Bereiche, die sich zwischen Geweben mit sehr unterschiedlichen Eigenschaften befinden. Natürliche Gewebeübergänge weisen mehrfache Gradienten auf: Gradienten der Struktur, der Zusammensetzung und der daraus folgenden Funktionalität. Derartige Gewebeübergänge spielen im Bereich der Orthopädie eine besondere Rolle. Sie sind häufig durch pathologische Prozesse in ihrer Funktionalität beeinträchtigt. Fortwährende Behandlungskosten, Revisionsoperationen und trotzdem unbefriedigende klinische Ergebnisse stellen ein erhebliches Problem dar. Beispielhaft soll in der DFG-geförderten Forschungsgruppe FOR 2180 „Gradierte Implantate für Sehnen-Knochen-Verbindungen“ die Schulter adressiert werden: www.gradierte-implantate.de. Ziel ist es, die prinzipielle Machbarkeit und modellhafte Herstellung eines neuartigen biodegradierbaren und mehrfach gradierten Implantats für einen zukünftigen Einsatz am Sehnen-Knochen-Übergang der Rotatorenmanschette aufzuzeigen. Die FOR 2180 umspannt Fachgebiete aus den Ingenieur-, Natur- und Lebenswissenschaften und der Medizin. Dabei sind drei niedersächsische Hochschulen – MHH, Leibniz Universität und Technische Universität Braunschweig beteiligt. Die AG-Leiterin ist Sprecherin dieses Verbundprojekts.
Interaktion von Biomaterialien und Immunsystem. Bisherige Ergebnisse der FOR 2180 zeigen eine massive Fremdkörperreaktion und Fibrose. Wir nehmen an, dass die Auswirkungen von Entzündungen und Immunreaktionen bei zukünftigen Entwicklungen regenerativer Therapien einschließlich Biomaterialien und Implantaten stärker berücksichtigt werden sollten. Beispielsweise könnten entzündungshemmende und immunmodulatorische Ansätze in vielen Fällen die erfolgreiche Regeneration nachhaltig fördern oder erst ermöglichen, einschließlich der Potenzierung von Stammzell- und Wachstumsfaktoreffekten. Künftig möchten wir dafür maßgeschneiderte Strategien entwickeln und spezifische Immunzellpopulationen charakterisieren.
Beiträge zum MHH-Forschungsschwerpunkt „Onkologie“
Veränderung von MSCs durch Sarkome. In den letzten Jahren erhielten wir aus der orthopädischen Klinik einige Knochenmarkproben von Patient_innen mit Sarkomdiagnose. Daraus isolierten wir MSCs und charakterisierten ihr RNA-Profil. Es zeigen sich Veränderungen, welche Zellen von Sarkompatient_innen und Patient_innen ohne Tumordiagnose voneinander unterscheiden. Außerdem weist jedes Sarkom möglicherweise spezifische Veränderungen auf. Zukünftig möchten wir ausgewählte Gene funktionell charakterisieren und die Analytik auf weitere Zellpopulationen erweitern.
Ausgewählte Publikationen der letzten 5 Jahre (Fettdruck: Mitarbeiter_innen AG Hoffmann)
*: gleichwertige Beiträge, #: Korrespondenz
Friese, N., Gierschner, M.B., Schadzek, P., Roger, Y., Hoffmann, A. (2020):
Regeneration of Damaged Tendon-Bone Junctions (Entheses): TAK1 as a Potential Node Factor.
Int J Mol Sci;21:E5177.
Lavrentieva, A.*, Hoffmann, A.*, Lee-Thedieck, C.* (2020):
Limited Potential or Unfavorable Manipulations? Strategies Toward Efficient Mesenchymal Stem/Stromal Cell-Applications.
Front Cell Dev Biol;8:316
Roger, Y., Sydow, S., Burmeister, L., Menzel, H., Hoffmann, A.# (2020):
Sustained release of TGF-β3 from polysaccharide nanoparticles induces chondrogenic differentiation of human mesenchymal stromal cells.
Colloids Surf B Biointerfaces;189:110843
Roger, Y., Burmeister, L., Hamm, A., Elger, K., Dittrich-Breiholz, O., Flörkemeier, T.*, Hoffmann, A.* # (2020):
Heparin Anticoagulant for Human Bone Marrow Does Not Influence In Vitro Performance of Human Mesenchymal Stromal Cells.
Cells;9(7):E1580
Winkel, A., Jaimes, Y., Melzer, C., Dillschneider, P., Hartwig, H., Stiesch, M., von der Ohe, J., Strauss, S., Vogt, P.M., Hamm, A., Burmeister, L., Roger, Y., Elger, K., Flörkemeier, T., Weissinger, E.M., Pogozhykh, O., Müller, T., Selich, A., Rothe, M., Petri, S., Köhl, U., Hass, R., Hoffmann, A.# (2020):
Cell culture media notably influence properties of human mesenchymal stroma/stem-like cells from different tissues.
Cytotherapy;22:653-668
Gniesmer, S., Brehm, R., Hoffmann, A., de Cassan, D., Menzel, H., Hoheisel, A.-L., Glasmacher, B., Willbold, E., Reifenrath, J., Ludwig, N., Zimmerer, R., Tavassol, F., Gellrich, N.-C., Kampmann, A. (2020):
Vascularization and biocompatibility of poly(ε-caprolactone) fiber mats for rotator cuff tear repair.
PLoS One;15(1):e0227563.
Schwieger, J., Hamm, A., Gepp, M.M., Schulz, A., Hoffmann, A., Lenarz, T., Scheper, V. (2020):
Alginate-encapsulated Brain Derived Neurotrophic Factor-overexpressing mesenchymal stem cells are a promising drug delivery system for protection of auditory neurons.
J Tissue Eng.;11:1-15
De Cassan, D., Becker, A., Glasmacher, B., Roger, Y., Hoffmann, A., Gengenbach, T.R., Easton, C. D., Hänsch, R., Menzel, H. (2020):
Blending chitosan-g-poly(caprolactone) with poly(caprolactone) by electrospinning to produce functional fiber mats for tissue engineering applications.
J Appl Polym Sci; DOI: 10.1002/APP.48650
Willbold, E.; Wellmann, M. Welke, B., Angrisani, N., Gniesmer, S., Kampmann, A., Hoffmann, A., De Cassan, D., Menzel, H., Hoheisel, A.-L., Glasmacher, B., Reifenrath, J. (2020):
Possibilities and limitations of electrospun chitosan-coated polycaprolactone grafts for rotator cuff tear repair
J Tissue Eng Regen Med;14(1):186-197
Scheper, V., Schwieger, J., Hamm, A., Lenarz, T., Hoffmann, A. (2019):
BDNF-overexpressing humen mesenchymal stem cells mediate increased neuronal protection in vitro.
J Neurosci Res;97(11):1414-1429
Weist, R., Flörkemeier, T., Roger, Y., Noack, S., Franke, A., Schwanke, K., Zweigerdt, R., Martin, U., Willbold E.*, Hoffmann, A.* # (2018):
Differential expression of cholinergic system components in human induced pluripotent stem cells, bone marrow-derived multipotent stromal cells, and induced pluripotent stem cell-derived multipotent stromal cells.
Stem Cells Dev;27;166-183
Hoffmann, A., Floerkemeier, T., Melzer, C., Hass, R. (2017):
Comparison of in vitro-cultivation of human mesenchymal stroma/stem cells derived from bone marrow and umbilical cord.
J Tissue Eng Regen Med; 11(9):2565-2581
Extras:
Prof.´in Dr. Andrea Hoffmann: Sprecherin der DFG-FOR 2180, Mitglied im wiss. Beirat des „Rostock Centre for Interdisciplinary Implant Research” ROCINI, Mitglied von AcademiaNet.
Lehre:
“Adulte Stammzellen in der regenerativen Medizin“ (Vorlesung)
„Entwicklung von Zelltherapeutika: Experimentelle Anwendungen und klinischer Einsatz von adulten Stammzellen“ (Ringvorlesung)
„Einführung in die tierische Zellkulturtechnik“ (Praktikum im NIFE)
Lehrpreis 2021 für Prof. Dr. Andrea Hoffmann