Aktuelle Forschungsinteressen
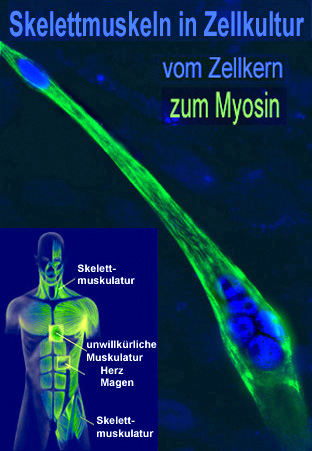
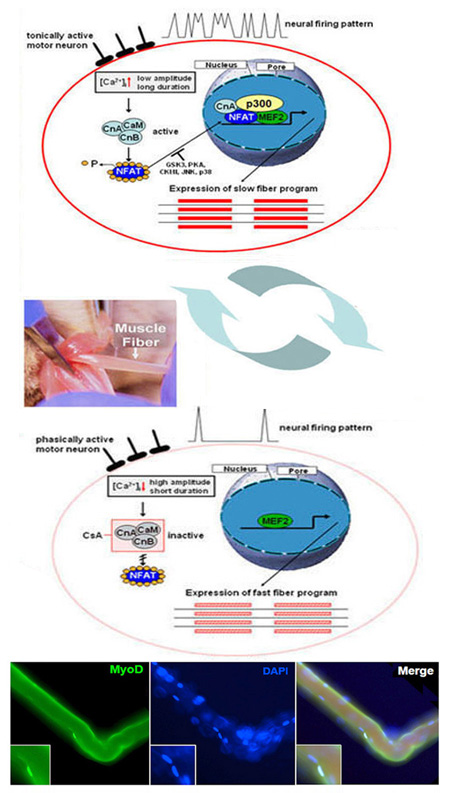
Mehrkernige adulte Skelettmuskelzellen entwickeln sich in einem komplexen Differenzierungsprozess aus einkernigen Vorläuferzellen, den Myoblasten. Die adulten Skelettmuskelzellen (Myotuben) bestehen aus verschiedenen Muskelfasern. Sie zeichnen sich durch eine ausgeprägte Plastizität aus. Diese Plastizität, auch Transformation oder Fasertypshift genannt, ist eines der herausragenden Merkmale des Skelettmuskels. Sie treten bei veränderten physiologischen Anforderungen, wie Ausdauertraining auf, aber auch während inaktivitäts-induzierter Immobilität, Alterung, Fettleibigkeit, Erkrankungen des Muskels (Duchenne muscular dystrophy) oder nicht-muskuläre Erkrankungen (Diabetes Typ II). Dabei kann eine schnelle Muskelfaser (hohe ATPase-Aktivität; schnelle Ermüdbarkeit) unter Dauerbelastung in eine langsame Muskelfaser (niedrige ATPase-Aktivität; geringe Ermüdbarkeit) umgewandelt. Eine grosse Bedeutung hat dabei die Änderungen der intrazellulären Calcium-Konzentration ([Ca2+]i). Dessen Anstieg aktiviert im Muskel die Calcium-abhängige Phosphatase Calcineurin und Calcineurin-abhängige Signaltransduktionswege. Dabei spielt die Dephosphorylierung und Aktivierung des Transkriptionsfaktors NFAT (Isoform c1), sowie die darauffolgende nukleare Translokation eine wichtige Rolle für die Ausbildung des langsamen fasertyp-spezifischen Genprogramms. Neben der Dephosphorylierung konnten wir zeigen, dass NFATc1 durch weiter posttranslationale Modifikationen (PMTs) verändert wird.
Weiterhin sind mitogen-aktivierte Proteinkinasen (MAPKs), insbesondere die p38 MAPK und möglicherweise auch die MAPK-aktivierten Proteinkinasen 2 und 3 (MK2/3), als Regulator bei Muskeldifferenzierungsprozessen und beim Erhalt des schnellen Muskelfasertyps beteiligt. In welchem Ausmaß die beiden genannten Signaltransduktionswege interagieren, wird untersucht. Soweit bekannt, bewirkt ein Absinken von [Ca2+]i , sowie die Aktivierungen der p38 MAPK (Isoform a/b) und des Transkriptionsfaktors MEF2C, die Genexpression der schnellen fasertyp-spezifischen schweren Kette des Myosins IId/x.
Beispiele für die medizinische Relevanz:
Die Fasertyptransformation spielt gegenwärtig eine Rolle bei der Therapie von Herzeninsuffizienz (cardiac assist), bei der Therapie von inaktivitäts-induzierter Muskelatrophie z.B. bei Bettlägerigkeit und der Behandlung des Muskelabbaus im Alter, der zur Muskelschwäche und zur Fallneigung führt.
Wissenschaftliche Fragestellungen:
1.) Untersuchungen zur physiologischen Funktion der MAPK-aktivierten Proteinkinasen 2 und 2 (MK2/3) im Skellettmuskel und im Herzen von doppel-knockout-Mäusen sowie in der Muskelzelllinie C2C12;
2.) Einfluss von posttranslationalen Modifikationen (Acetylierung/ SUMOylierung) der verschiedenen auf die Regulation von Zielgenen im Skelett-/Herzmuskel.
Methoden im Labor: Klonierung, Promoteranalyse, Pull-down Assay, EMSA, RNA silencing, Mutagenese, ChIP, Muskelzellkultur, etc.