Weitere Nachrichten auf der Startseite
Das humanisierte Leber/Maus-Modell zur Erforschung der NAFLD
Die nichtalkoholische Fettlebererkrankung (NAFLD) ist eine rasch wachsende globale Herausforderung, von der inzwischen mehr als ein Viertel der Weltbevölkerung betroffen ist.
Die Mechanismen, die die NAFLD zur nichtalkoholischen Steatohepatitis (NASH) und/oder weiter zur Zirrhose bis hin zum Leberkrebs fortschreiten lassen, sind nur unzureichend bekannt und hängen u.a. mit ernährungsbedingten und genetischen Risikofaktoren zusammen.
In den letzten Jahren wurden mehrere genetische Polymorphismen mit der fortgeschrittenen NAFLD in Verbindung gebracht. Hervorzuheben ist insbesondere die 148M-Variante der Lipase „Patatin-like phospholipase domain-containing protein 3“ (PNPLA3-I148M), welche mit der fortgeschrittenen NAFLD assoziiert ist u.a. unabhängig von BMI und/oder Diabetes Status.
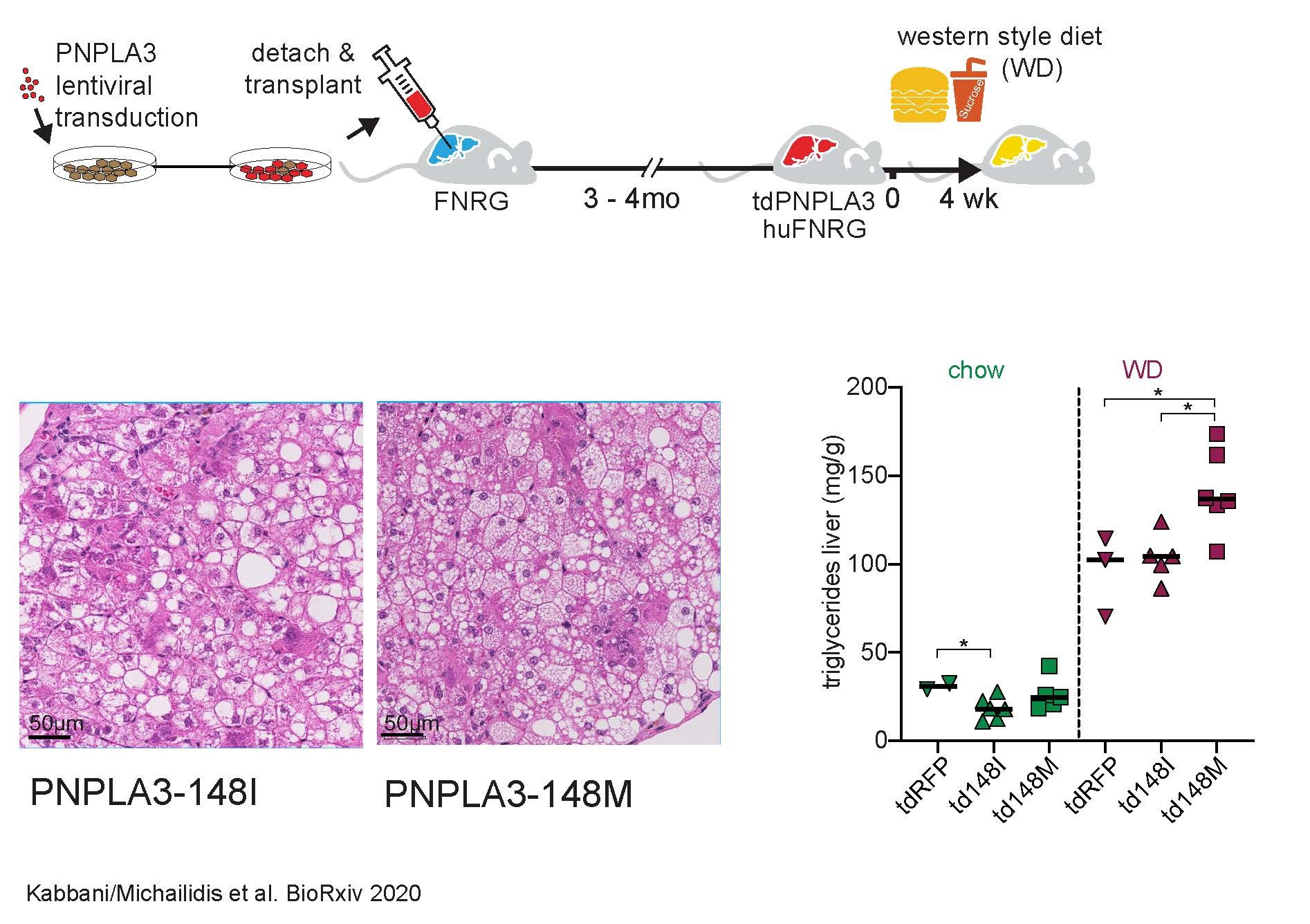
Die genauen Pathomechanismen, die auf die 148M-Variante beim Menschen zurückzuführen sind, sind trotz zahlreicher Untersuchungen nach wie vor unklar. Bisher eingesetzte Mausstudien könnten die Erkenntnisse darüber, wie die 148M Variante das Fortschreiten der Krankheit verursacht, erschwert haben: Das Pnpla3 der Maus ist nur zu 68 % homolog zum menschlichem PNPLA3. Darüber hinaus wird das menschliche PNPLA3 vor allem in der Leber exprimiert, bei der Maus hingegen im Fettgewebe.
Um diese und andere Hürden zu überwinden, entwickelten wir im Rahmen eines DFG-geförderten Forschungsaufenthalt im Labor des Nobelpreisträgers von 2020, Prof. Charles Rice, an der Rockefeller University in New York, das humanisierte Leber/Maus-Modell weiter zum Einsatz für die NAFLD-Forschung.
Hierbei werden menschliche Hepatozyten in immunsupprimierten Mäusen injiziert und ersetzen einen Großteil der Mausleberzellen, sodass die Mausleber „humanisiert“ wird. Durch Humanisierung von Mäusen mit Hepatozyten der 148M-Variante (sei es als Träger der Variante oder aber mittels forcierter lentiviraler Überexpression) konnten wir nach vorausgegangener vierwöchiger hyperakalorischer Diät westlicher Art (einer Art Fastfood Diät) zeigen, dass die 148M-Variante zu einer besonders aggressiven NAFLD führt, u.a. auch mit der Entstehung einer mikrovesikulären Steatose. Besonders interessant war jedoch die Beobachtung, dass es in den humanisierten Mäusen trotz der Abwesenheit von T- und B-Zellen zu einer Steatoheapatitis gekommen ist u.a. mit Leberenzymanstieg und der Ballonierung von Hepatozyten. Dies unterstreicht umso mehr die zentrale Rolle von Hepatozyten bei der Entstehung der Steatohepatitis – unabhängig eines adaptiven Immunsystems.
Als nächstes möchten wir das humanisierte Leber/Maus-Model zur Erforschung der NAFLD an der MHH etablieren, um so dann den Einfluss unterschiedlicher hyperkalorischer Diäten im Kontext von genetischen Risikofaktoren weiter zu untersuchen. Auch andere genetische Risikofaktoren für NAFLD, die bisher in Mausmodellen nicht untersucht werden konnten, da z.B. kein murines Ortholog bisher beschrieben worden ist (z.B. HSD17B13), können an dem Modell untersucht werden. Langfristig sind auch therapeutische Interventionen am humanisierten Leber/Maus-Modell denkbar, insbesondere auch der Einsatz innovativer Gentherapien an menschlichen Hepatozyten in vivo.
Weitere Informationen erhalten Sie bei: Dr. Mohammad Kabbani, kabbani.mohammad@mh-hannover.de
