Intensivmedizin

Um klinische sowie wissenschaftliche und translationale Fragen so präzise wie möglich zu beantworten, haben wir eine Kooperation zwischen drei großen universitären Intensivstationen in Deutschland und der Schweiz gegründet, nämlich Bonn-Hannover-Zürich – die BonHanZA (Bonn-Hannover-Zürich-ARDS) Studiengruppe. Co-PIs dieser Gruppe sind Prof. Sascha David (USZ, Zürich), Dr. Pedro Wendel-Garcia (USZ, Zürich), Prof. Christian Bode (UKB, Bonn), PD Benjamin Seeliger (MHH, Hannover) und Prof. Dr. Klaus Stahl (MHH, Hannover).
Unser experimentelles Interesse gilt einem besseren Verständnis der Prozesse, die der Pathologie von ARDS und septischem Schock zugrunde liegen, mit einem Schwerpunkt auf der Rolle von Immundysregulation und Endothelschäden.
Klinisch haben wir zahlreiche retrospektive und prospektive Kooperationsstudien initiiert, die sowohl bestehende Therapieansätze in großen Patientenkollektiven evaluieren als auch neue Behandlungsoptionen bei Patienten mit ARDS und septischem Schock untersuchen. Ein besonderer Schwerpunkt liegt auf der Bewertung des aktuellen Stands der ECMO-Unterstützung sowie neuer extrakorporaler Behandlungsmodalitäten für den septischen Schock.
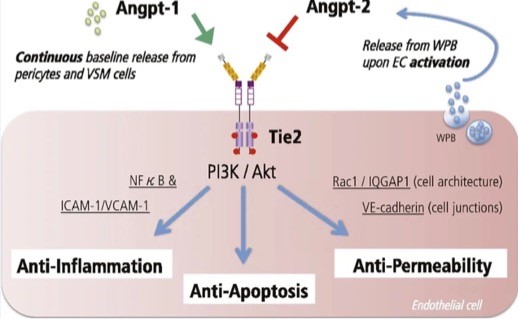
Unsere Gruppe interessiert sich für molekulare Mechanismen, die die Endothelbarrierefunktion als Reaktion auf Entzündungen regulieren. In den letzten zehn Jahren haben wir uns auf das Angiopoietin (Angpt)/Tie2-Liganden-Rezeptor-System konzentriert. Tie2 ist ein transmembranärer Rezeptor-Tyrosinkinase, der für die Entwicklung embryonaler Gefäße unerlässlich ist. In reifen Organismen verlagert sich seine Funktion hin zur Aufrechterhaltung der endothelialen Homöostase und zur Reaktion auf Schädigungen. Angpt-1 ist der wichtigste zirkulierende Tie2-Agonist, der schützende Anti-Permeabilitätssignale fördert, während Angpt-2 antagonistische Eigenschaften hat. Unsere Gruppe war die erste, die in einem murinen Knockout-Modell nachweisen konnte, dass Angpt-2 direkt zur Morbidität und Mortalität bei Sepsis beiträgt.
Unsere Gruppe interessiert sich für molekulare Mechanismen, die die Endothelbarrierefunktion als Reaktion auf Entzündungen regulieren. In den letzten zehn Jahren haben wir uns auf das Angiopoietin (Angpt)/Tie2-Liganden-Rezeptor-System konzentriert.
Tie2 ist ein transmembranärer Rezeptor-Tyrosinkinase, der für die Entwicklung embryonaler Gefäße unerlässlich ist. In reifen Organismen verlagert sich seine Funktion auf die Aufrechterhaltung der endothelialen Homöostase und die Reaktion auf Schädigungen. Angpt-1 ist der wichtigste zirkulierende Tie2-Agonist, der schützende Anti-Permeabilitätssignale fördert, während Angpt-2 antagonistische Eigenschaften hat. Unsere Gruppe war die erste, die in einem murinen Knockout-Modell nachweisen konnte, dass Angpt-2 direkt zur Morbidität und Mortalität bei Sepsis beiträgt.
Auf der Grundlage dieser Erkenntnis haben wir eine Reihe von Experimenten durchgeführt, um potenzielle therapeutische Strategien (Antikörper, siRNA usw.) zur Eliminierung oder Blockierung des schädlichen Angpt-2-Proteins in Sepsis-Modellen zu untersuchen. Außerdem führen wir Screenings zur Umwidmung von Arzneimitteln durch, um potenzielle Off-Target-Regulatoren von Angpt-2 zu identifizieren. In letzter Zeit haben wir viel Aufmerksamkeit auf die Regulation der Tie2-Rezeptorexpression an sich gelenkt und arbeiten derzeit an den zugrunde liegenden Mechanismen der posttranslationalen Tie2-Modifikationen.
Wir interessieren uns auch für die Interaktion zwischen Endothelzellen und Perizyten – sowohl im Hinblick auf die Angiopoietin-Signalübertragung als auch auf die Regulation von bioaktivem Adrenomedullin (bioADM).
Ein weiterer Schwerpunkt liegt auf der Untersuchung des endothelialen Glykokalyx sowohl in vivo (SDF-Bildgebung) als auch in vitro (endotheliales Mikroperfusions-Chip-Modell). Da eine Schädigung des endothelialen Glykokalyx bereits in einem frühen Stadium einer kritischen Erkrankung festgestellt werden kann und wesentlich zur endothelialen Dysfunktion beiträgt, untersuchen wir die Regulation des Glykokalyx-Abbaus sowohl bei septischem Schock als auch bei schwerem COVID-19.
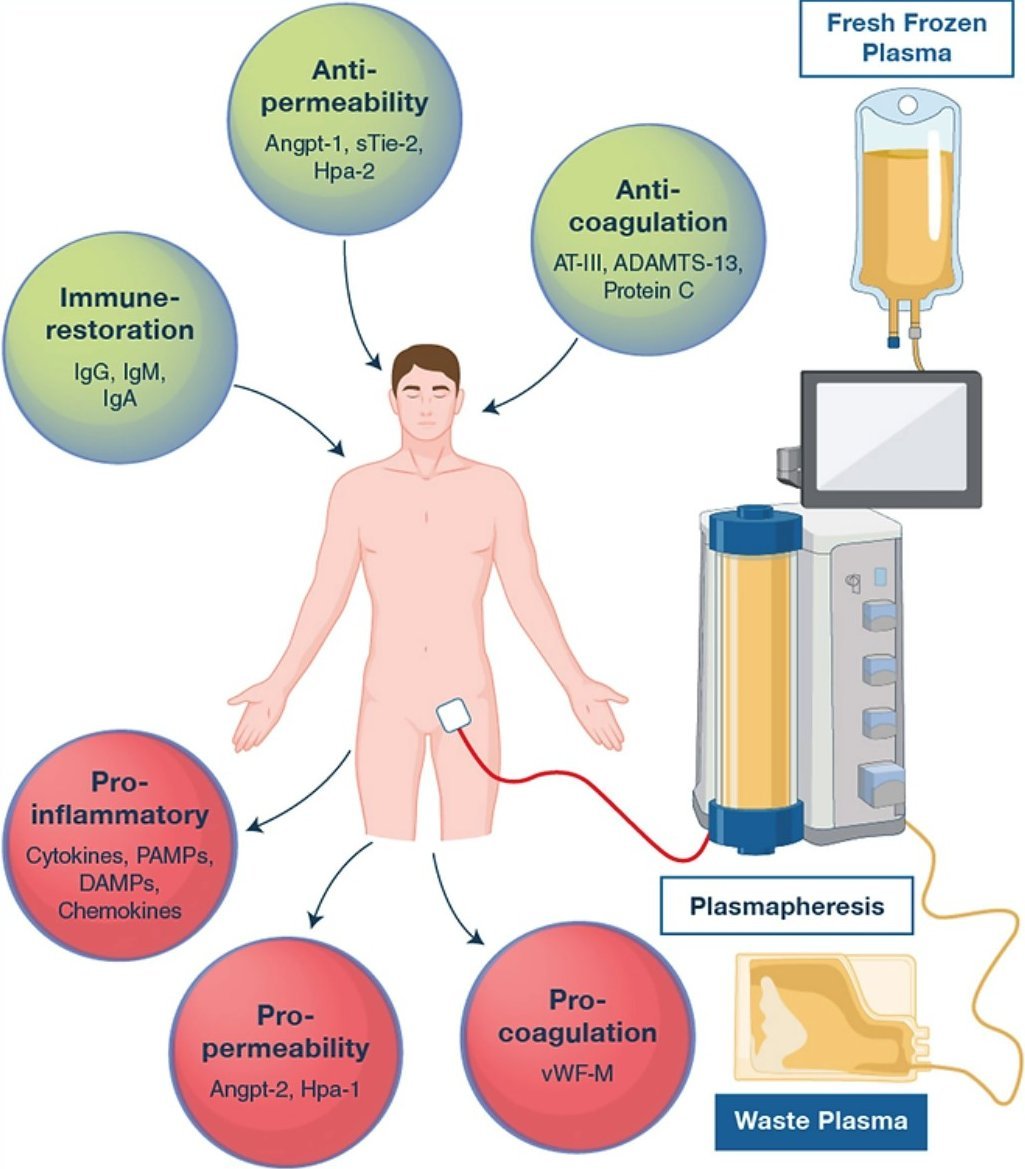
Das Kennzeichen einer Sepsis ist eine pathologische Reaktion des Wirts auf eine Infektion, die zu Organfunktionsstörungen, Schock und letztlich zu einer hohen Sterblichkeit führen kann. Neben zahlreichen zirkulierenden Mediatoren, die eine Entzündungskaskade auslösen, einem Zusammenbruch der Gefäßbarriere und einer mikrovaskulären Hypoperfusion trägt auch der Verbrauch und der anschließende Mangel an schützenden Plasmaproteinen zusätzlich zur Pathophysiologie der Sepsis bei. Eine ursächliche Sepsis-Therapie, die auf die pathologische Reaktion des Wirts abzielt, fehlt noch, da die selektive Hemmung einzelner Mediatoren wie TLR4 oder TNF beim Menschen bislang nicht wirksam war.
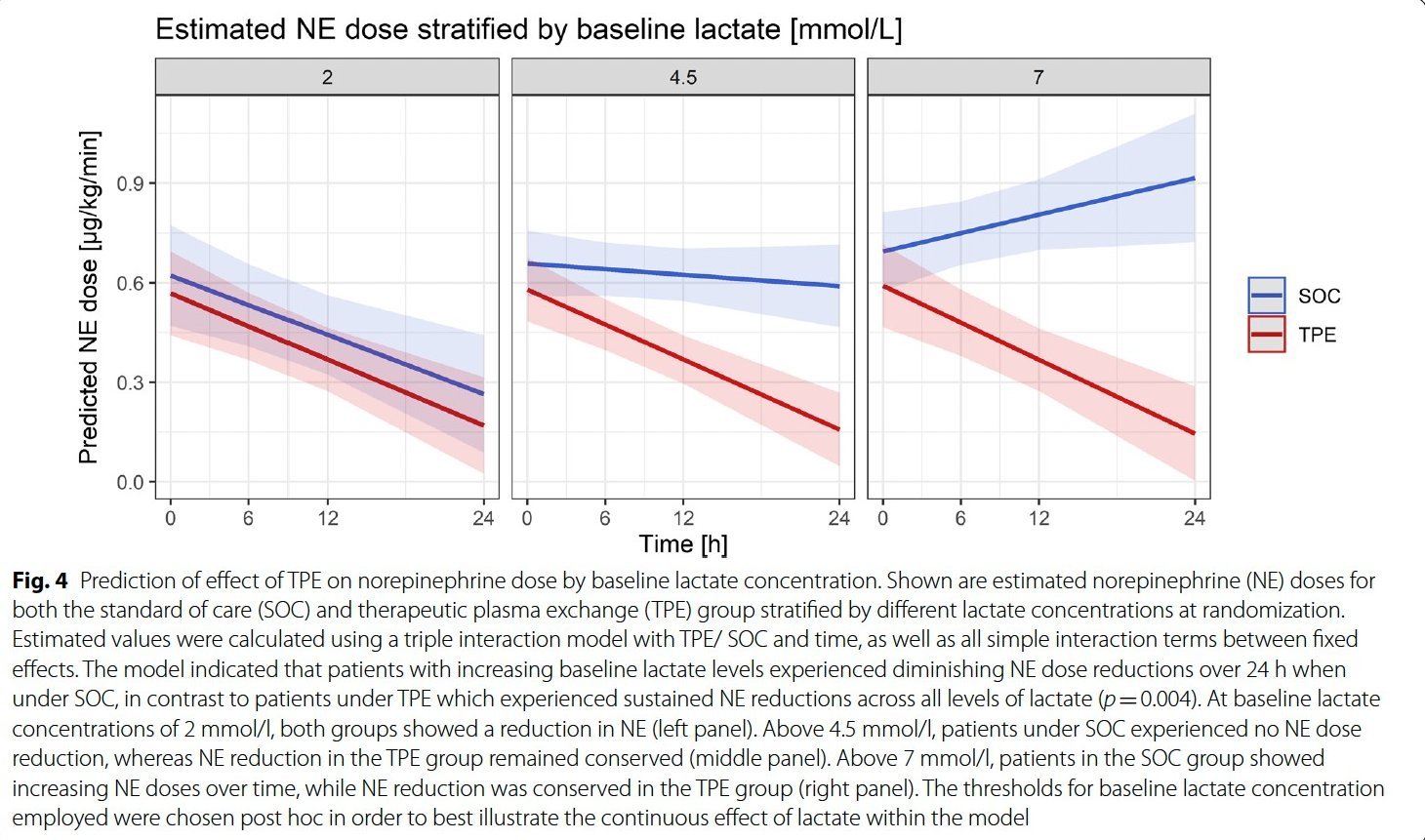
Wir glauben, dass die therapeutische Plasmaaustauschtherapie (TPE) zahlreiche zirkulierende schädliche Mediatoren in einer kurzen Intervention eliminieren und gleichzeitig essentielle, aber bereits verbrauchte Schutzfaktoren ersetzen könnte. Wir haben daher ein Studienprogramm initiiert, das die Wirkung einer frühzeitigen TPE bei Patienten mit frühzeitigem refraktärem septischem Schock untersucht (EXCHANGE-Studienprogramm). In einer prospektiven, nicht randomisierten Pilotstudie konnten wir zeigen, dass eine frühzeitige TPE die Hämodynamik und die Endothelpermeabilität verbessert sowie entzündliche Zytokine bei Patienten mit septischem Schock reduziert (EXCHANGE Pilot). In einer anschließenden zweizentrischen (Hannover und Bonn) randomisierten kontrollierten Studie konnten wir diesen Befund hinsichtlich der Wirkung der TPE auf die schnelle Wiederherstellung der hämodynamischen Stabilität in einer kontrollierten Umgebung bestätigen (EXCHANGE I). Die Finanzierung für eine multizentrische randomisierte kontrollierte Studie zur Untersuchung des Einsatzes von TPE bei septischem Schock (EXCHANGE II) wurde unserer Gruppe von der DFG bewilligt, und die Studie steht kurz vor dem Start der Rekrutierung in mehr als 20 Zentren in Deutschland, Österreich und der Schweiz.
Derzeit führen wir mehrere translationale Untersuchungen durch, die die molekularen Mechanismen der Sepsis (z. B. Endothelfunktion, Glykokalyxschädigung, Dysregulation der Immunantworten und Gerinnung) weiter aufklären, die möglicherweise alle durch additive TPE beeinflusst werden, sowie Prädiktoren für das Ansprechen auf TPE.
Neutrophile extrazelluläre Fallen (NETs) spielen eine wichtige Rolle in der Pathophysiologie von Sepsis und ARDS, da sie aktiv an Hyperinflammation und mikrovaskulärer Gerinnung beteiligt sind. Zusammen mit unseren Kollegen vom Guy´s and St. Thomas NHS Foundation Trust in London haben wir eine multizentrische randomisierte kontrollierte Studie geplant, um den additiven Einsatz einer NET-spezifischen Adsorptionssäule bei Patienten mit Sepsis und ARDS zu untersuchen (NucCap-Studie).
Die biologische Heterogenität, die bei Sepsis und ARDS auftritt, könnte zu den enttäuschenden Ergebnissen randomisierter kontrollierter Studien beitragen, in denen die Auswirkungen pharmakologischer Interventionen in einer nicht ausgewählten Population untersucht wurden. Die Präzisionsmedizin konzentriert sich auf die Identifizierung von Therapiestrategien, die für eine Gruppe von Patienten mit ähnlichen gemeinsamen Merkmalen wirksam sind. Da Präzisionsmedizinansätze in nicht-kritischen Versorgungssituationen wie der Krebsbehandlung in letzter Zeit erfolgreich durchgeführt wurden, wollen wir die biologischen Grundlagen der Subphänotypen von Sepsis und ARDS verstehen, damit personalisierte Therapieansätze angewendet werden können.
Um Patienten mit Sepsis und ARDS sowohl nach klinischen als auch nach biologischen Phänotypen weiter zu stratifizieren, haben wir ein prospektives Register für Patienten mit ARDS und Sepsis (SPARE-14-Register) in Kombination mit einer longitudinalen Human-Biobank (Blut und bronchoalveoläre Lavageflüssigkeiten) eingerichtet. Bislang wurden mehr als 250 hochgradig charakterisierte Sepsis-/ARDS-Patienten in diese Datenbank aufgenommen. Wir streben danach, individuelle Patientenmerkmale zu erforschen, sowohl in Bezug auf routinemäßige klinische Parameter als auch auf nicht routinemäßig gemessene Krankheitsmediatoren, die den Krankheitsverlauf und das Ansprechen auf die Behandlung beeinflussen könnten.
Obwohl es noch immer an eindeutigen Daten mangelt, die den Einsatz der extrakorporalen Membranoxygenierung (ECMO) bei schwerem ARDS hinsichtlich der Überlebensvorteile belegen, hat sich die ECMO für viele Patienten zu einem therapeutischen Eckpfeiler entwickelt, und ihr Einsatz ist in der modernen Intensivmedizin von großem Interesse.
Unsere Gruppe versucht, besser zu verstehen, wer letztendlich von ECMO profitieren könnte, und arbeitet daran, die Art und Weise zu verbessern, wie die ECMO-Unterstützung durchgeführt wird (z. B. individuelle Wahl der Antikoagulationsintensität). Wir untersuchen auch die ECMO-Unterstützung bei nicht-traditionellen Patientengruppen, wie z. B. Patienten mit diffuser alveolärer Blutung. Die Unterstützung von nicht intubierten Patienten mit chronischem und akutem Lungenversagen durch ECMO, die als „Awake ECMO” bezeichnet wird, ist eine innovative Strategie, da sie die zahlreichen potenziellen Nebenwirkungen der invasiven Beatmung möglicherweise vollständig vermeidet. Wir untersuchen diese Strategie bei sorgfältig ausgewählten Patientengruppen mit singulärem Lungenversagen, wie z. B. Patienten mit Pneumocystis-assoziiertem ARDS.
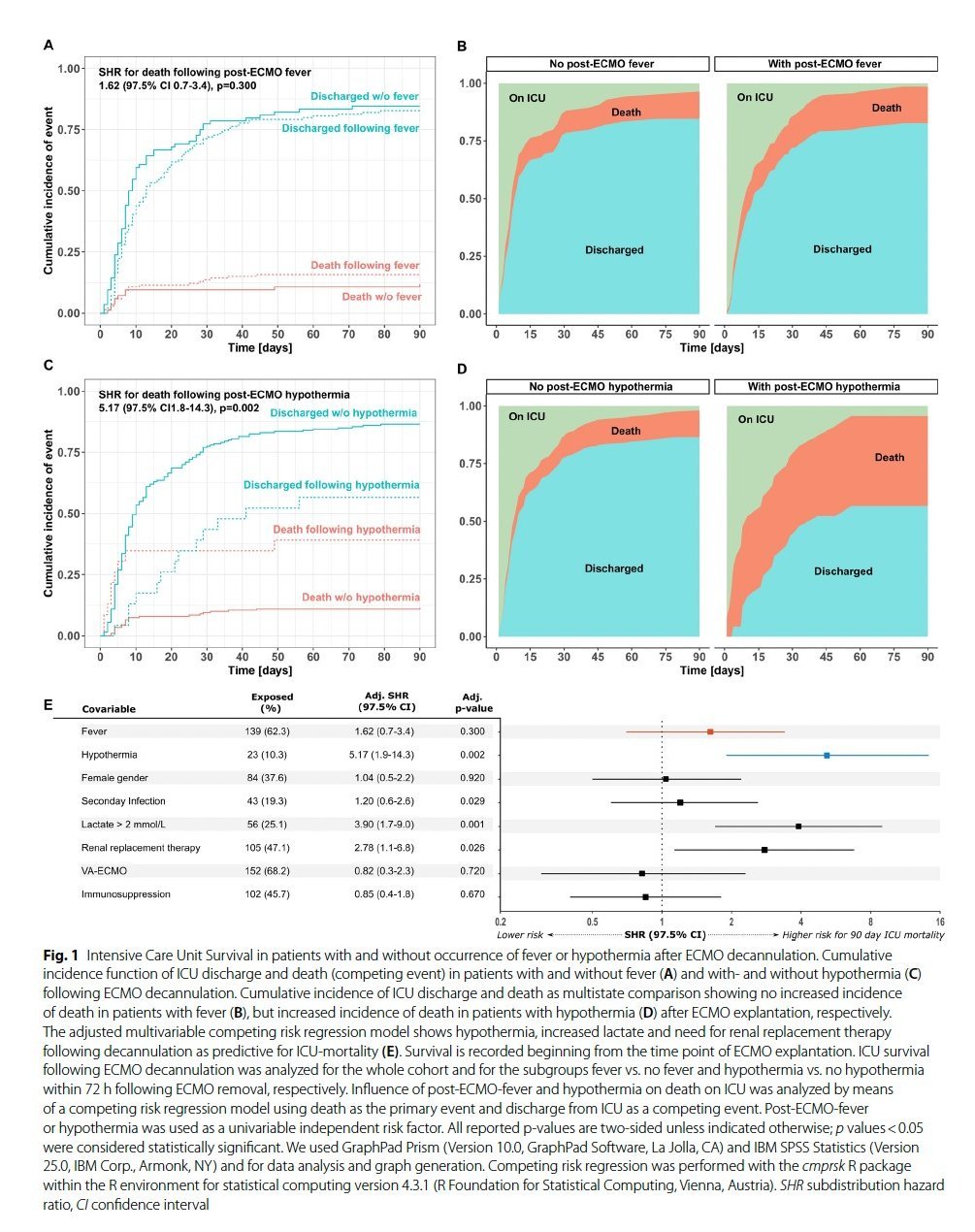
Fieber nach der ECMO-Dekanülierung ist ein sehr häufiges Phänomen, dessen klinische Bedeutung jedoch bislang unklar war. In einer aktuellen Studie haben wir die Rolle von Hyper- und Hypothermie nach der ECMO-Dekanülierung aufgeklärt.
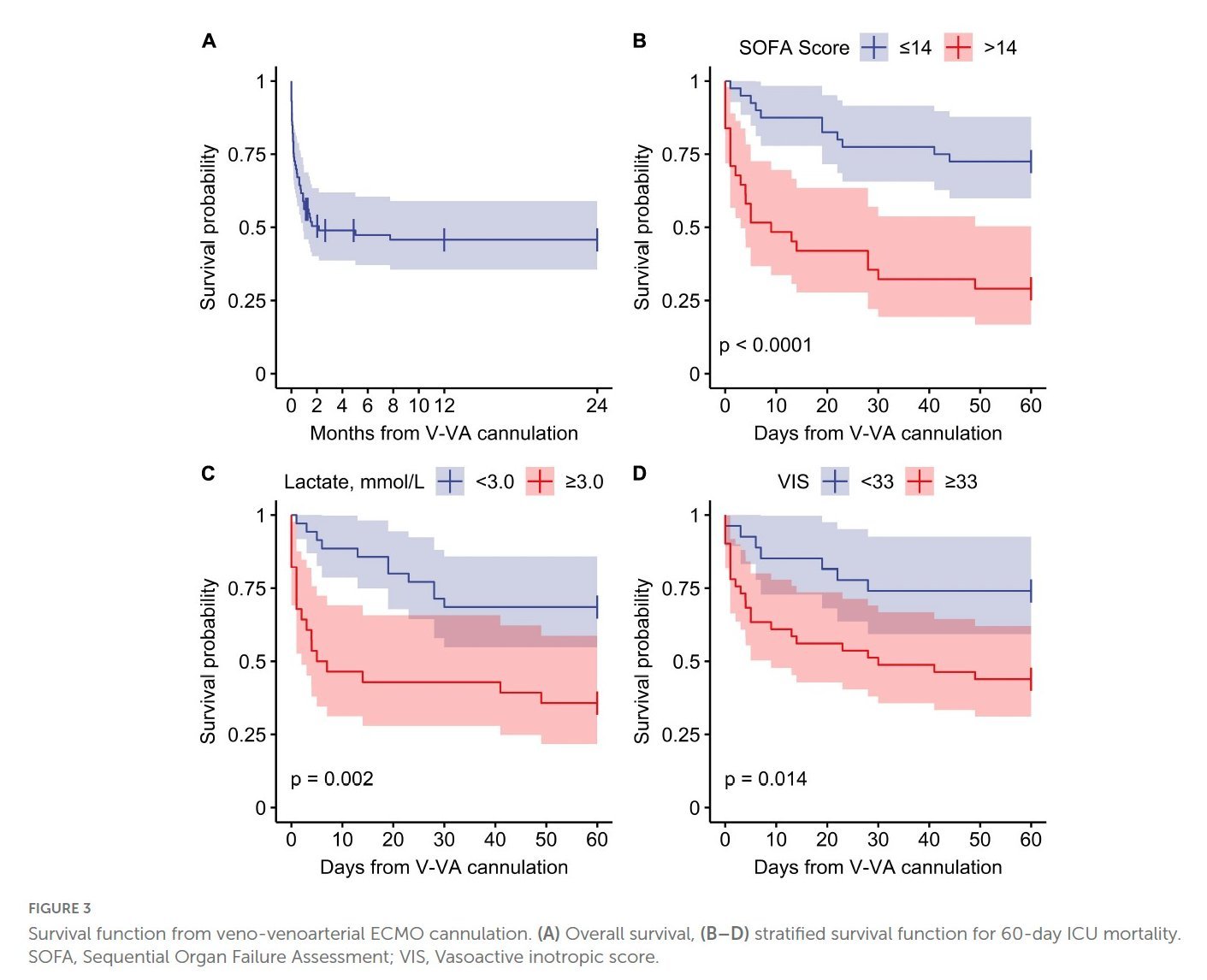
Eine Arbeit, die die Langzeitergebnisse von ARDS-Patienten mit Dreifachkanülierung analysierte, bei denen zusätzlich eine Herzinsuffizienz auftrat (VVA-ECMO), und die unter der Leitung von Rolf Erlebach und Klaus Stahl durchgeführt wurde, wurde kürzlich mit Fördermitteln der ESICM und der DGIIN ausgezeichnet.
Die nicht-okklusive mesenteriale Ischämie (NOMI) ist eine lebensbedrohliche Erkrankung, die bei Patienten mit Schock auftritt und durch eine Vasokonstriktion der Mesenterialarterien gekennzeichnet ist, die zu einer Darmischämie und einem Multiorganversagen führt. Obwohl die minimalinvasive lokale intraarterielle Infusion von Vasodilatatoren in den Mesenterialkreislauf als therapeutische Option bei NOMI vorgeschlagen wurde, basieren die aktuellen Erkenntnisse auf retrospektiven Fallserien, und es bleibt unklar, welche Patienten davon profitieren könnten. Unsere Gruppe hat zusammen mit der Gruppe von Jan Hinrich sowohl frühe klinische Indikatoren für NOMI identifiziert als auch prospektiv Prädiktoren für das Ansprechen auf eine intraarterielle Therapie bei Patienten mit NOMI analysiert. Wir beteiligen uns an einer multizentrischen Studie zur Erforschung neuer Biomarker für eine bessere Diagnose der akuten mesenterialen Ischämie (BIPAMI-Studie).
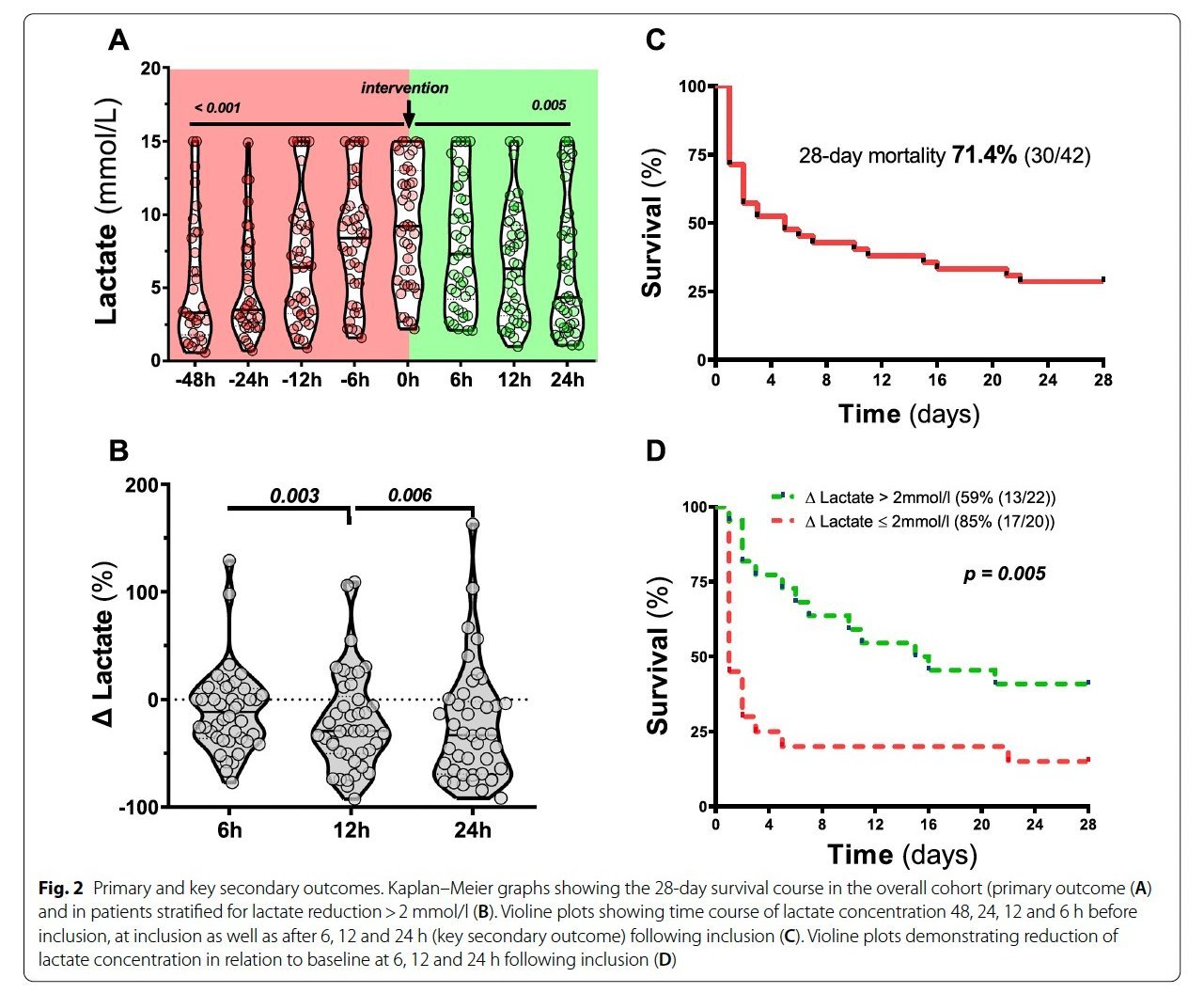
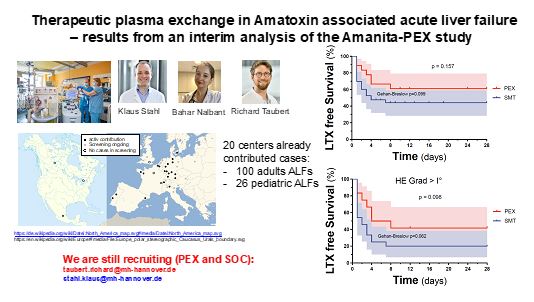
Amatoxin-bedingtes akutes Leberversagen (AT-ALF) ist mit einer hohen Mortalität verbunden, wenn keine dringende Lebertransplantation (LTX) durchgeführt wird. Es wurde nachgewiesen, dass eine therapeutische Plasmaaustauschtherapie (PEX) das LTX-freie Überleben bei Patienten mit ALF anderer Ursachen verbessert. Es ist jedoch unklar, ob PEX auch das LTX-freie Überleben bei AT-ALF verbessern kann, und die klinische Praxis bei der Anwendung von PEX bei AT-ALF variiert erheblich zwischen den verschiedenen Zentren. Aufgrund der Seltenheit dieser ALF-Entität scheint die Durchführung einer randomisierten kontrollierten Studie zur Untersuchung der Anwendung von PEX bei AT-ALF in Zukunft nicht realisierbar zu sein.
Wir (Richard Taubert, Bahar Nalbant und Klaus Stahl) haben eine laufende multizentrische, internationale, retrospektive Kohortenstudie (Amanita-PEX-Studie, NCT06187220) initiiert, um die Wirkung einer additiven PEX im Vergleich zur alleinigen Standardmedikation (SMT) bei AT-ALF zu untersuchen. Bislang haben bereits 20 Zentren mehr als 120 Patienten beigesteuert, und es ist ein klarer Trend zum Nutzen von PEX bei AT-ALF zu beobachten. Wir sind offen für weitere Zentren, die sich beteiligen möchten.
Endoskopie
Unsere Gruppe befasst sich mit verschiedenen offenen Fragen zum aktuellen Stand der interventionellen Endoskopie, wobei ein besonderer Schwerpunkt auf biliären (ERC und PTBD) und EUS-gesteuerten Interventionen sowie Strategien zur Verbesserung der Sicherheit der endoskopischen Sedierung (Temperaturkontrolle, CPAP-Beatmung) liegt.
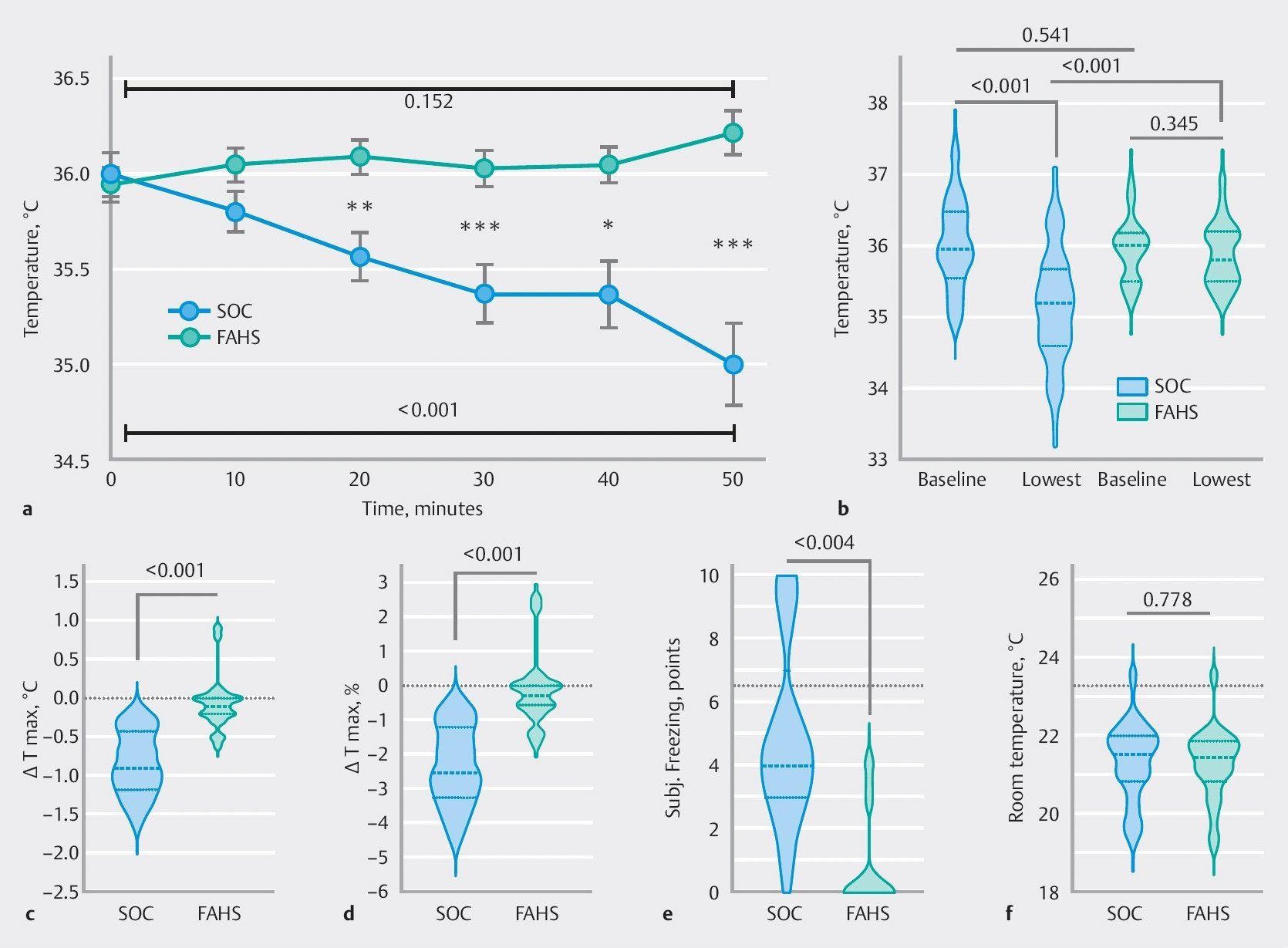
Perioperative Hypothermie ist mit erheblichen Komplikationen verbunden und kann mit Hilfe von Warmluftheizsystemen (FAHS) verhindert werden. Ob Hypothermie während einer längeren endoskopischen Sedierung auftritt, war jedoch unklar, und Präventionsmaßnahmen wurden in den Leitlinien zur endoskopischen Sedierung nicht behandelt. Unsere Gruppe (Henrike Lenzen und Klaus Stahl) stellte die Hypothese auf, dass Hypothermie auch bei einem erheblichen Anteil der Patienten auftritt, die sich endoskopischen Eingriffen mit längeren Sedierungszeiten wie ERCP unterziehen, und dass FAHS dies verhindern kann. Wir führten daher eine prospektive Beobachtungsstudie durch, die zeigte, dass bei der Mehrheit der Patienten, die sich einer längeren endoskopischen Sedierung ohne aktive Temperaturkontrolle unterzogen, tatsächlich eine Hypothermie auftrat. FAHS war mit einer höheren Temperaturstabilität während der Sedierung und einem besseren Patientenkomfort verbunden. Diese Studie wurde 2024 mit dem ersten Preis der DGE-BV ausgezeichnet.
Unter der Leitung von Thomas von Hahn werden wir an einer randomisierten kontrollierten Studie teilnehmen, in der untersucht wird, ob die Verwendung einer einfachen nasalen CPAP-Maske (SuperNO2VA™) im Vergleich zur Standardversorgung (d. h. Nasenkanüle mit 2 l/min O2-Durchfluss) Hypoxämie-Episoden bei adipösen und übergewichtigen Patienten reduziert, die sich einer oberen Endoskopie unter Propofol-Sedierung unterziehen, die von einem Nicht-Anästhesisten verabreicht wird (nicht-anästhesiologisch verabreichte Propofol-Sedierung (NAPS)).
Gallenwegverengungen gehören zu den häufigsten Komplikationen nach einer Lebertransplantation (LTX). Wenn die endoskopische retrograde Cholangiographie fehlschlägt, kann die perkutane transhepatische Gallengangsdrainage (PTBD) als alternativer Ansatz dienen. Die Beschreibung klinisch wichtiger kurz- und langfristiger Ergebnisse sowie die Ergebnisprognose nach PTBD nach LTX sind jedoch rar. Unsere Gruppe analysiert sowohl die Ergebnisse als auch die Ergebnisprognose bei pädiatrischen und erwachsenen Patienten, die nach einer LTX eine PTCD-gesteuerte Gallentherapie wegen Gallengangsverengungen erhalten.
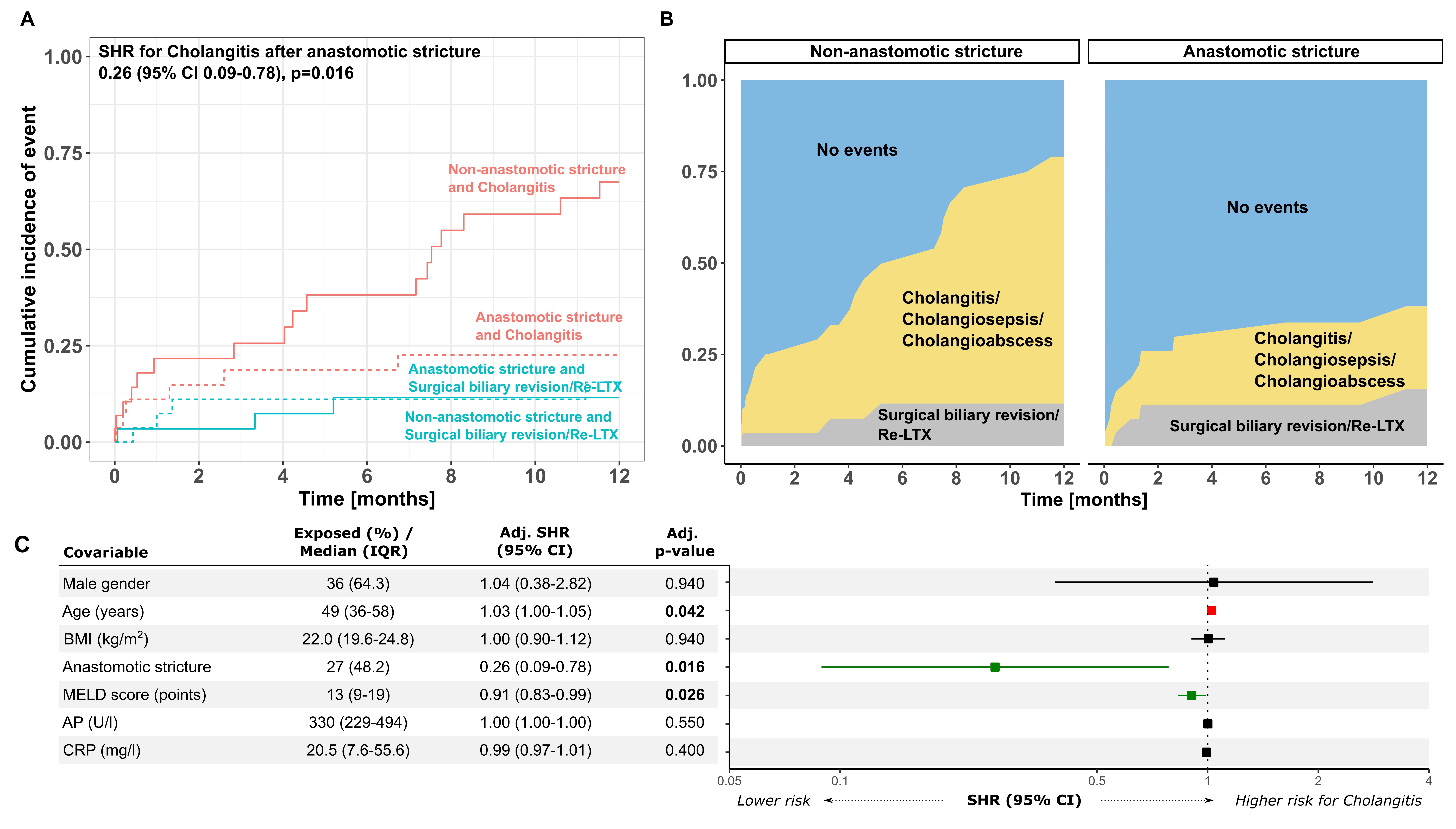
Der optimale Zeitpunkt für die EUS-Drainage von pankreatischen ANCs ist nach wie vor unklar. Während die POINTER-Studie eine spätere Drainage (> 4 Wochen) empfiehlt, ist unklar, ob eine sehr frühe Drainage (< 2 Wochen) sicher ist, wenn sie in Notfallsituationen durchgeführt werden muss. Gemeinsam mit der Gruppe von Thomas von Hahn aus Hamburg analysieren wir in einem laufenden Projekt, ob eine sehr frühe (< 2 Wochen) EUS-Drainage infizierter pankreatischer ANCs in Notfallsituationen sicher ist und welche Faktoren einen günstigen Ausgang vorhersagen.
Die sekundär sklerosierende Cholangitis (SSC) ist eine Erkrankung, die durch eine fortschreitende Zerstörung der Gallenwege gekennzeichnet ist und durch eine Vielzahl von Auslösern verursacht werden kann, darunter toxische und infektiöse Erreger, immunvermittelte Mechanismen und Ischämie. In den letzten Jahren wurde eine neue Unterkategorie der SSC bei kritisch kranken Patienten definiert (SSC-CIP). SSC-CIP tritt Wochen oder Monate nach dem Auftreten einer Vielzahl schwerwiegender Erkrankungen auf, darunter schwere Traumata, Verbrennungen, größere thorakale oder abdominale Operationen, Sepsis/septischer Schock und akutes Atemnotsyndrom (ARDS). SSC-CIP führt häufig zu wiederkehrender akuter Cholangitis und Cholangiosepsis, Leberzirrhose, hepatischer Dekompensation und schließlich zum Tod. Die Prognose von SSC-CIP ist mit einer geschätzten 1-Jahres-Überlebensrate von etwa 50 % sehr ungünstig.
Zu den Behandlungsansätzen für Patienten mit SSC-CIP gehören endoskopische Eingriffe unter Verwendung der endoskopischen retrograden Cholangiographie (ERC) mit Sphinkterotomie, Entfernung von Gallensteinen, Spülung der Gallengänge, Dilatationstherapie, Stentimplantation oder Einlage von nasobiliären Drainagen. Es ist jedoch noch unklar, welche Untergruppen von Patienten mit SSC-CIP von einem solchen Eingriff profitieren. Da die ERC eine Untersuchung ist, die mit potenziell schweren postoperativen Nebenwirkungen verbunden ist, wäre gleichzeitig ein genaueres Verständnis der Prädiktoren für den zu erwartenden Therapieerfolg unter ERC bei Patienten mit SSC-CIP von entscheidender Bedeutung.
Die histopathologische Charakterisierung mittels transjugulärer Leberbiopsie (TJLB) kann theoretisch zur Klärung der genauen Ätiologie des akuten Leberversagens (ALF) beitragen. Es ist unklar, ob die histopathologischen Informationen aus der TJLB aufgrund der geringen Probengröße einen wesentlichen Beitrag zur Diagnose der Ursachen des ALF, zur Steuerung der Therapieentscheidungen oder zur Vorhersage der Gesamtprognose leisten. In einer laufenden Studie analysieren wir die Sicherheit und klinische Bedeutung der TJLB bei Patienten mit ALF.
Weitere Informationen
Intensivmedizin:
- Prof. Dr. Sascha David, Institute of Intensive Care Medicine, University Hopsital Zurich, Switzerland
- PD Dr. Benjmain Seeliger and Prof. Dr. Marius Hoeper, Respiratory and Critical Care Medicine, Hannover Medical School
- Prof. Dr. Christian Bode, Operative Intensive Care Medicine, University Hospital Bonn
- PD Dr. Heiko Schenk and Prof. Dr. Hermann Haller, Nephrology, Hannover Medical School and Mount Desert Island Biological Laboratory, Maine, USA
- Prof. Dr. Michael Joannidis, University Hospital Innsbruck, Austria
- PD Dr. Christian Nusshag and Prof. Dr. Markus Weigand, University Hospital Heidelberg
- Prof. Dr. Samir Parikh, MD, BIDMC and Harvard Medical School, Boston, MA, USA
- Dr. Andrew Aswani, MD, PhD, Critical Care Medicine and Anesthesia, Guy’s and St. Thomas’ NHS Foundation Trust, London, UK
- Prof. Dr. Jan T Kielstein, Medical Clinic V, Nephrology, Rheumatology, Blood Purification, Academic Teaching Hospital Brunswick
- Prof. Dr. Jan Hinrichs, Interventional Radiology, Hannover Medical School
- Prof. Dr. Ulrich Budde, Hemostasiology, University Hospital Hamburg
- Prof. Dr. Malgorzata Wygrecka, PhD, Biochemistry, University Gießen
- The EXCHANGE-II study group (> 20 centers in Germany, Austria and Switzerland)
- The AMANITA-PEX study group (> 20 centers in Europe and North America)
Endoskopie:
- Prof. Dr. Thomas von Hahn, Academic Teaching Hospital Hamburg Barmbek
- PD Dr. Henrike Lenzen, Academic Teaching Hospital Brunswick
- Prof. Dr. Silke Leonhardt, Charite University Hospital Berlin
- Deutsche Forschungsgemeinschaft“ (DFG)
- Cytosorbents AG
- Santersus AG
Team
Prof. Dr. med. Klaus Stahl
Klinik für Gastroenterologie, Hepatologie, Infektiologie und Endokrinologie
Medizinische Hochschule Hannover OE 6810
Carl-Neuberg-Str. 1
30625 Hannover

- Dr. Thorben Pape
- Dr. Bahar Nalbant
- Dr. Nina Rittgerodt
- Dr. Ann-Kathrin Rath
- Cand med. Eloise C. Schuette
- Cand med. Tabea von Garrel
- Cand med. Lea Plum
- The BonHanZA study group (https://www.bonhanza.com/)
- Dr. med. Philipp Gronski
- Dr. med. Philipp Wand
