AG Amrute-Nayak

Entschlüsselung der Funktion/Dysfunktion von Motorproteinen mittels
Einzelmolekül-Biophysik.
Forschungsschwerpunkte
Zytoskelettmotoren sind ATP-abhängige krafterzeugende biologische Maschinen, die verschiedene Aufgaben ausführen, wie z.B. intrazellulären Frachttransport, Muskelkontraktion, Zellteilung und Bewegung ganzer Zellen.
Das nicht-prozessive Myosin-II-Motorprotein ist verantwortlich für die Kontraktion von Skelettmuskelfasern und Herzmuskelzellen, während prozessive aktinbasierte Motorproteine, wie das Myosin V, am intrazellulären Transport beteiligt sind. Das Hauptziel unserer Forschung ist es, ein detailliertes Verständnis der Mechanismen zu gewinnen, mit denen verschiedene Motoren unterschiedliche Rollen erfüllen.
Funktionsstörungen von Motorproteinen haben entscheidende Einflüsse in nahezu allen Aspekten der zellulären Physiologie und sind eng mit verschiedenen Myopathien verbunden, unter anderem mit der Herzerkrankung der familiären Kardiomyopathie (FHC), von der 1 von 200 Personen weltweit betroffen ist. Klinische Phänotypen weisen eine hohe Variabilität auf, die von asymptomatisch über schnell fortschreitendes Herzversagen bis hin zu plötzlichem Herztod bei jungen Menschen und Leistungssportlern reicht.
Wir wollen ein umfassendes Verständnis der primären funktionellen Veränderung des kardialen β-Myosins als Folge von Punktmutationen erlangen. Die Dysfunktion von Motorproteinen führt zu einer Desorganisation des Myokards, die zur Hypertrophie des linken Ventrikels beiträgt.
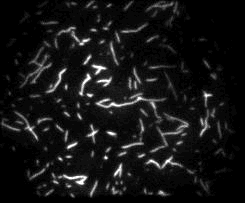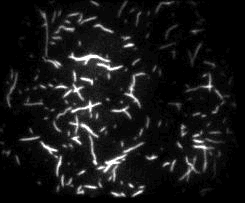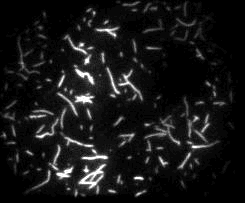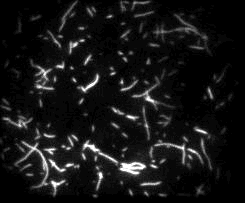
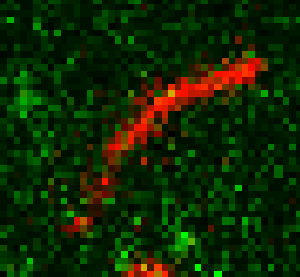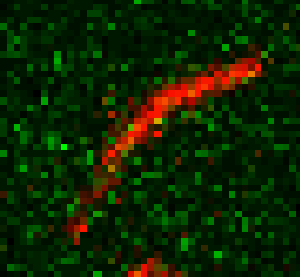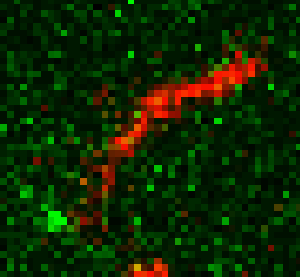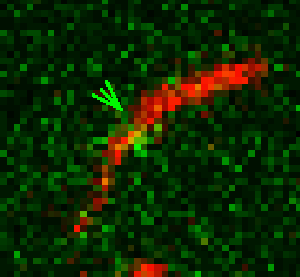
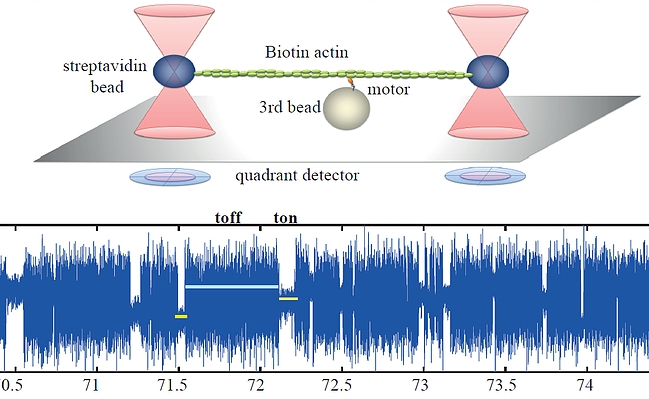
Unsere experimentellen Ansätze umfassen biophysikalische Einzelmoleküluntersuchungen, wie Total Internal Reflection Fluorescence Microscopy (TIRFM), Zero-Mode-Lichtwellenleiter und optische Fallen, um präzise kinetische und mechanische Einblicke in Motorproteine zu erhalten.
- Modulatorische Rolle von Unterkomponenten der Motorproteine
- Entwicklung neuer Nano-Biohybrid-Motoren auf Basis natürlicher Bausteine
- Einzelmoleküluntersuchungen von mutierten Myosin-Motorproteinen, die an der humanen hypertrophen Kardiomyopathie beteiligt sind
- Epigenetische Regulation der Physiologie von quergestreiften Muskeln durch Ubiquitin-ähnliche Proteine
Wir verwenden eine Vielzahl von innovativen experimentellen Ansätzen.
Für die eingehende Analyse der Funktion von Motorproteinen verwenden wir hauptsächlich biophysikalische Einzelmoleküluntersuchungen, wie Total Internal Reflection-Fluoreszenzmikroskopie (TIRF-M), optische Fallen und Zero-Mode-Lichtwellenleiter, um präzise kinetische und mechanische Einblicke in Motorproteine zu erhalten.
Für unsere Projekte zur epigenetischen Regulation der Muskelphysiologie verwenden wir verschiedene biochemische und molekularbiologische Werkzeuge, wie In-Vivo-Co-IP-, Protein-Netzwerkanalyse mittels quantitativer Massenspektrometrie und Genexpressions-Array-System, Chromatin-Immunpräzipitation und ChIPseq.


Selected publications
-
Single-Molecule Investigation of Load-Dependent Actomyosin Dissociation Kinetics for Cardiac and Slow Skeletal Myosin, Wang T, Nayak A, Kraft T, Amrute-Nayak M., Nano Micro Small. 2024 Oct 7:e2406865.
doi: 10.1002/smll.202406865. Online ahead of print., Pubmed, Journal Link -
Sorafenib induces cachexia by impeding transcriptional signaling of the SET1/MLL complex on muscle-specific genes,
Bushra Khan, Chiara Lanzuolo, Valentina Rosti, Philina Santarelli, Andreas Pich,Theresia Kraft, Mamta Amrute-Nayak, Arnab Nayak, iScience . 2024 Sep 10;27(10):110913. eCollection 2024 Oct 18, https://doi.org/10.1016/j.isci.2024.110913, Link Journal, PubMed -
PyChelator: a Python-based Colab and web application for metal chelator calculations, Emrulla Spahiu, Esra Kastrati & Mamta Amrute-Nayak, BMC Bioinformatics volume 25, Article number: 239 (2024), DOI: 10.1186/s12859-024-05858-8, Pubmed
-
Cardiac ventricular myosin and slow skeletal myosin exhibit dissimilar chemomechanical properties despite bearing the same myosin heavy chain isoform, Tianbang Wang, Emrulla Spahiu, Jennifer Osten, Florentine Behrens, Fabius Grünhagen, Tim Scholz, Theresia Kraft, Arnab Nayak, Mamta Amrute-Nayak J Biol Chem . 2022 May 24;102070. doi: 10.1016/j.jbc.2022.102070. [Online ahead of print] PubMed
- Acto-Myosin Cross-Bridge Stiffness Depends on the Nucleotide State of Myosin II. Wang T, Brenner B, Nayak A, and Amrute-Nayak M. Nano Letters, 2020 Sep 15. doi: 10.1021/acs.nanolett.0c02960. [Online ahead of print] PubMed
- Transformation of the Nonprocessive Fast Skeletal Myosin II into a Processive Motor. Amrute-Nayak M*, Nayak A, Steffen W, Tsiavaliaris G, Scholz T, Brenner B. Small. 2019 Jan 18:e1804313. doi: 10.1002/smll.201804313. (* - Corresponding author, IF - 9.598); PubMed
- MARK4 regulates NLRP3 positioning and inflammasome activation through a microtubule-dependent mechanism. Li X, Thome S, Ma X, Amrute-Nayak M, Finigan A, Kitt L, Masters L, James JR, Shi Y, Meng G, Mallat Z. Nat Commun. 2017 Jun 28. (IF - 12.353)
- ATP turnover by individual myosin molecules hints at two conformers of the myosin active site. Amrute-Nayak M, Lambeck KA, Radocaj A, Huhnt HE, Scholz T, Hahn N, Tsiavaliaris G, Walter WJ, Brenner B. Proc Natl Acad Sci U S A. 2014 Feb 18. (IF - 9.504)
- Single-molecule assays reveal that RNA localization signals regulate dynein-dynactin copy number on individual transcript cargoes. Amrute-Nayak M, Bullock SL. Nat Cell Biol. 2012 Feb 26. (IF - 20.06)
- Targeted optimization of a protein nanomachine for operation in biohybrid devices. Amrute-Nayak M, Diensthuber RP, Steffen W, Kathmann D, Hartmann FK, Fedorov R, Urbanke C, Manstein DJ, Brenner B, Tsiavaliaris G. Angew Chem Int Ed Engl. 2010. (IF - 12.10)
Internationale Kooperationspartner
Dr. Xuan Li, Heart and lung Research institute, Cambridge, UK
Prof. Michael Regnier, Heart and Muscle Mechanics (HAMM) Lab, University of Washington, Seattle, USA
Prof. Christopher Johnson, Department of Chemistry, Mississippi state University, USA
Prof. Marco Capitanio, LENS - European Laboratory for Non-Linear Spectroscopy, Florence, Italy
Prof. Alf Månsson, Faculty of Health and Life Sciences, Linnaeus University, Sweden
Prof. Pasquale Bianco/Dr. Irene Pertici/ Prof. Vincenzo Lombardi, University of Florence, Florence, Italy
Prof. Sean Lal, Faculty of Medicine and Health, University of Sydney, Australia
Kooperationspartner in der MHH
Prof. Georgios Tsiavaliaris, Biophysical Chemistry, Hannover Medical School, Germany
Dr. med. Karsten Hufendiek, Klinik für Augenheilkunde, Hannover Medical School, Germany
Förderung
- German Research Foundation (DFG)
- Hochschulinterne Förderung (HilF, MHH)
- Fritz Thyssen Foundation
Labor Mitarbeiter/-innen

Für meinen Master (M. Sc.) habe ich Biochemie an der Universität Pune, Indien, studiert.
Für meine Promotion habe ich mich dem Forschungslabor von Prof. Bernhard Brenner an der Medizinischen Hochschule Hannover (MHH) angeschlossen. Hier habe ich ein Projekt durchgeführt, bei dem molekulare Motorproteine mit der Einzelmolekül-Fluoreszenzdetektionstechnik "Total Internal Reflection Fluorescence Microscopy" untersucht wurden.
Für meine Postdoktorandenzeit bin ich zum Medical Research Council - Laboratrory of Molecular Biology (MRC-LMB), Cambridge, Großbritannien, gewechstelt, um mit Dr. Simon Bullock zusammenzuarbeiten. Dabei habe ich den molekularen Mechanismus des cytoplasmatischen mRNA-Transports untersucht. Wir haben versucht, die Wechselwirkung von Lokalisierungssignalen mit Mikrotubuli-basierten Motoren aufzuklären, die die mRNA durch ein komplexes Zytoskelett-Netzwerk führen und unterschiedliche mRNAs sortieren.
2017 habe ich meine eigene Arbeitsgruppe an der Medizinischen Hochschule Hannover gegründet. Das Hauptaugenmerk meines Labors liegt auf der Untersuchung von molekularen Mechanismen, die der Motorproteinfunktion zugrunde liegen. Darüber hinaus untersuchen wir natürlich vorkommende Mutationen in sarkomerischen Proteinen, die an der hypertrophen Kardiomyopathie (HCM) beim Menschen beteiligt sind.

Tianbang hat seine Doktorarbeit in der Arbeitsgruppe von PD Dr. Walter Steffen, am Institut für Molekular und Zellphysiologie, Medizinische Hochschule Hannover, abgeschlossen. Sein Promotionsprojekt umfasste die Untersuchung des Krafterzeugungsmechanismus von zytoplasmatischem Dynein.
Seit Juli 2018 arbeitet er als Postdoktorand in der Arbeitsgruppe von Dr. Mamta Amrute-Nayak, am Institut für Molekular und Zellphysiologie, Medizinische Hochschule Hannover
Sein Projekt beinhaltet:
- Charakterisierung der mechanischen und kinetischen Eigenschaften von β-Herz-und Skelett- Myosin II.
- Untersuchung auf Kardiomyopathie-Mutationen vom humanen ventrikulären Myosin
- Technikentwicklung der optischen Fallen
Publikationen:
- Acto-Myosin Cross-Bridge Stiffness Depends on the Nucleotide State of Myosin II. Wang T, Brenner B, Nayak A, and Amrute-Nayak M. Nano Letters, 2020 Sep 15. doi: 10.1021/acs.nanolett.0c02960. [Online ahead of print] PubMed
- Single-molecule analysis reveals that regulatory light chains fine-tune skeletal myosin-II function, Nayak A, Wang T, Franz P, Steffen W, Chizhov I, Tsiavaliaris G, Amrute-Nayak M, J Biol Chem. 2020 Apr 9. pii: jbc.RA120.012774. doi: 10.1074/jbc.RA120.012774, PMID: 32273340, Artikel, PubMed
- Increased Cell-Matrix Adhesion upon Constitutive Activation of Rho Proteins by Cytotoxic Necrotizing Factors from E. coli and Y. pseudotuberculosis. Martin May, Tanja Kolbe, Tianbang Wang, Gudula Schmidt, and Harald Genth. J Signal Transduct. 2012;2012:570183.
- Difference in F-actin depolymerization induced by toxin B from the Clostridium difficile strain VPI 10463 and toxin B from the variant Clostridium difficile serotype F strain 1470. May M, Wang T, Müller M, Genth H. Toxins (Basel). 2013 Jan 11;5(1):106-19.
- Mg2+-free ATP Regulates Native Cytoplasmic Dynein’s Processivity, VA Behrens, WJ Walter, C Peters, T Wang, B Brenner1, MA Geeves4, T Scholz1,5, W Steffen. FEBS Lett. 2018 Dec 21..
- The force generation of cytoplasmic dynein is load dependent. T Wang, WJ Walter, VA Behrens, W Steffen. Manuscript in preparation.
Sein Projekt beinhaltet die Untersuchung von Mutationen im kardialen Myosin II, die mit Kardiomyopathien verbunden sind, unter Verwendung von Einzelmolekül-Untersuchungsmethoden.
- Seit Mai 2025: Postdoktorand an der Medizinischen Hochschule Hannover (MHH) in der Molekular- und Zellphysiologi
- October 2020-April 2025: Doktorrand (Dr. rer. nat.) an der Medizinischen Hochschule Hannover (MHH) in der Molekular- und Zellphysiologie
- Emulla hat sein Masterstudium in Biologie an der Middle East Technical University (METU) in Ankara, Türkei, abgeschlossen.

Medizinstudent an der MHH im StrukMed-Programm
Ayesha completed her Bachelors studies (B.Sc.) in Microbiology from Government College University (GCU), Lahore, Pakistan. Later, she embarked on Masters studies (M.Sc) in Biology from Lahore University of Management Sciences (LUMS), Pakistan.
In August 2022, Ayesha joined the research group of Dr. Mamta Amrute-Nayak at the Institute for Molecular and Cell physiology to pursue her doctoral studies. Her project involves the investigation of molecular mechanisms underlying cardiac dysfunction in Hypertrophic Cardiomyopathy.

I completed my Bachelor of Science in Zoology from Midnapore College, India (2018-2021). Following this, I pursued a Master of Science in Biotechnology at the Rajiv Gandhi Centre for Biotechnology, India (2021-2023). I worked as a Junior Research Fellow at the National Brain Research Centre (2023-2024).
Since October 2024, I joined research group of Dr. Mamta Amrute-Nayak at the Institute for Molecular-and Cell Physiology to pursue my doctoral studies. My project involves single-molecule analysis of mutant myosin motors associated with human cardiomyopathy.

Medizinischen Technologin für Laboratoriumsanalytik (MTLA/MTA)
- Fabius Grünhagen
Mitglied des Forschungsteams als Student des FWJ (Freiwilliges Wissenschaftliches Jahr) von Oktober 2018 bis August 2019. Fabius studiert derzeit Physik an der Universität Zürich. - Khalaf Rasho
Wissenschaftlicher Mitarbeiter - Florentine Behrens
ist Zahnmedizinstudentin und promoviert derzeit in der Forschungsgruppe von Dr. Mamta Amrute-Nayak. Florentine untersuchte die Dysfunktion des kardialen Myosinmotors aufgrund einzelner Punktmutationen in der motorischen Unterkomponente, die beim Menschen bekanntermaßen eine Hypertrophie-Kardiomyopathie (HCM) verursacht.