Bewegungsstörungen
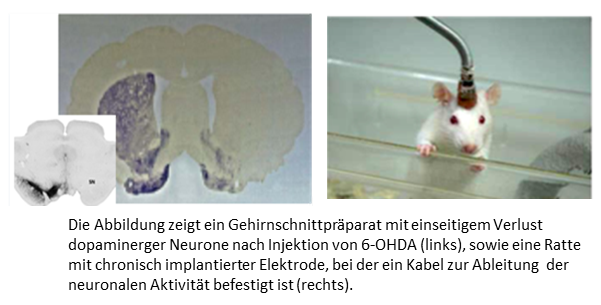
Als Tiermodell für Bewegungsstörungen verwenden wir hauptsächlich das 6-OHDA Parkinsonmodell der Ratte. Durch die lokale Injektion von 6-Hydroxydopamin (6-OHDA) in bestimmte Hirnregionen kommt es zur selektiven Degeneration dopaminerger Neurone im Mittelhirn. Dieses Modell bildet insbesondere die Veränderungen neuronaler Aktivität der Parkinson-Erkrankung realitätsnah ab und eignet sich daher besonders für präklinische Studien. Da die Injektion einseitig erfolgt, zeigen die Ratten nur sehr geringe motorische Störungen, die erst in speziellen Verhaltenstests sichtbar werden. Diese gehen jedoch mit einer abnormen neuronalen Aktivität einher, die der von Parkinsonerkrankten ähnelt. Zudem kann eine Injektion der dopaminergen Substanz Levodopa bei diesen Ratten für einige Minuten Dyskinesien (unwillkürliche, unkontrollierbare Bewegungen) auslösen. Solche Dyskinesien sind eine häufige klinische Nebenwirkung nach langjähriger dopaminerger Medikation bei Patienten mit Parkinson und eine der Hauptindikationen für die DBS. In der wachen, sich frei bewegenden Ratte testen wir die Effekte der DBS in verschiedenen klinisch bereits genutzten und potentiell neuen Zielregionen auf motorische Leistungen sowie auf Levodopa-induzierte Dyskinesien. Gleichzeitig leiten wir die neuronale Aktivität ausgewählter Hirnregionen und neuronaler Netzwerke in wachen Ratten ab. Dabei wird besonders darauf geachtet, dass die Bewegungsfreiheit der Ratte durch das angebrachte Stimulations- und Ableitungskabel nicht eingeschränkt wird. Wir haben bereits gezeigt, dass bei Ratten, die mit 6-OHDA behandelt wurden, die neuronale Aktivität in verschiedenen Frequenzbändern ähnlich wie bei Parkinson-Patienten verändert ist und durch DBS normalisiert werden kann. Diese Informationen nutzen wir, um die so genannte „adaptive Stimulation“ weiterzuentwickeln.
Abdulbaki A, Doll T, Helgers S, Heissler HE, Voges J, Krauss JK, Schwabe K, Alam M. Subthalamic Nucleus Deep Brain Stimulation Restores Motor and
Sensorimotor Cortical Neuronal Oscillatory Activity in the Free-Moving 6-Hydroxydopamine Lesion Rat Parkinson Model. Neuromodulation. 2024
Apr;27(3):489-499. DOI: 10.1016/j.neurom.2023.01.014
Abdul Nabi Ali A, Alam M, Klein SC, Behmann N, Krauss JK, Doll T, Blume H, Schwabe K. Predictive accuracy of CNN for cortical oscillatory activity in an
acute rat model of parkinsonism. Neural Netw. 2022 Feb;146:334-340. DOI: 10.1016/j.neunet.2021.11.025
Rumpel R, Alam M, Schwarz LM, Ratzka A, Jin X, Krauss JK, Grothe C, Schwabe K. Neuronal firing activity in the basal ganglia after striatal transplantation
of dopamine neurons in hemiparkinsonian rats. Neuroscience. 2017 Sep 30;360:197-209. DOI: 10.1016/j.neuroscience.2017.07.069
Alam M, Rumpel R, Jin X, von Wrangel C, Tschirner SK, Krauss JK, Grothe C, Ratzka A, Schwabe K. Altered somatosensory cortex neuronal activity in a rat
model of Parkinson's disease and levodopa-induced dyskinesias. Exp Neurol. 2017 Aug;294:19-31. DOI: 10.1016/j.expneurol.2017.04.011
Jin X, Schwabe K, Krauss JK, Alam M. Coherence of neuronal firing of the entopeduncular nucleus with motor cortex oscillatory activity in the 6-OHDA rat model of Parkinson's disease with levodopa-induced dyskinesias. Exp Brain Res. 2016 Apr;234(4):1105-18. DOI: 10.1007/s00221-015-4532-1
Alam M, Capelle HH, Schwabe K, Krauss JK. Effect of deep brain stimulation on levodopa-induced dyskinesias and striatal oscillatory local field potentials in
a rat model of Parkinson's disease. Brain Stimul. 2014 Jan-Feb;7(1):13-20. DOI: 10.1016/j.brs.2013.09.001
Förderung:
DFG Forschungsgruppe 2591 - SCHW1176/7-2
Kooperationen
Prof. Dr. Holger Blume (Institut für Mikroelektronik, LUH)