Gehirntumore
Trotz erheblicher Fortschritte in der neuroonkologischen Forschung bleibt die Behandlung von Hirntumoren problematisch. Dies gilt insbesondere für das Glioblastom, den prognostisch ungünstigsten bösartigen Hirntumor des Erwachsenen. Trotz einer Kombinationstherapie aus mikrochirurgischer Entfernung (Resektion) und begleitender Radiochemotherapie beträgt die mittlere Überlebenszeit nach wie vor nur ein bis zwei Jahre. Aufgrund des infiltrativen Wachstumsmusters beträgt die Rückfallquote (Rezidivrate) nach Resektion bis zu 90% nach einem Jahr.
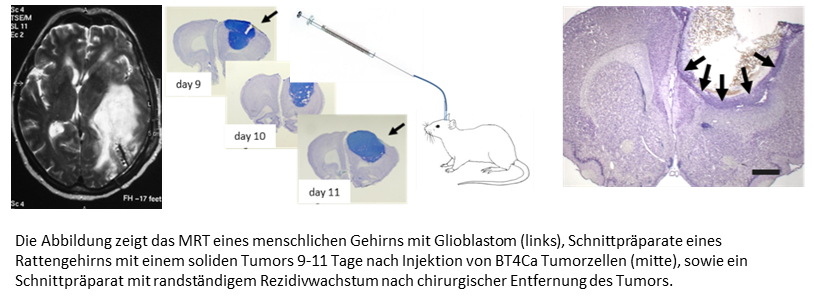
Ein Schwerpunkt des experimentellen Labors der Klinik ist die neuroonkologische Forschung mit Tumorzellen, die aus humanen Hirntumoren gewonnen werden, sowie mit Tumorzelllinien. Als Tiermodell verwenden wir die Glioblastomzelllinie BT4Ca, die nach stereotaktischer Injektion in frontale Hirnregionen von Ratten innerhalb weniger Tage zu einem soliden Tumor mit infiltrativem Wachstum heranwächst. Kurz nach einer mikrochirurgischen Resektion sind nur noch randständige Tumorzellen nachweisbar, aus denen sich nach etwa zwei Wochen wieder ein solider Tumor entwickelt. Dieses Rattenmodell eignet sich, um die lokale Wirksamkeit von Pharmaka, entweder nach Mikroinjektion oder nach Gabe in die Resektionshöhle, zu testen. In einem ähnlichen Aufbau wollen wir auch die Wirkung eines hochfrequenten elektrischen Wechselfeldes (TTF) auf das Tumorwachstum testen. Die Wirksamkeit eines solchen Feldes auf das Wachstum von Tumorzellen in Zellkultur wurde bereits gezeigt.
Möhn N, Hounchonou HF, Nay S, Schwenkenbecher P, Grote-Levi L, Al-Tarawni F, Esmaeilzadeh M, Schuchardt S, Schwabe K, Hildebrandt H, Thiesler H, Feuerhake F, Hartmann C, Skripuletz T, Krauss JK. Metabolomic profile of cerebrospinal fluid from patients with diffuse gliomas. J Neurol. 2024 Oct;271(10):6970-6982.
Helgers SOA, Talbot SR, Riedesel AK, Wassermann L, Wu Z, Krauss JK, Häger C, Bleich A, Schwabe K. Body weight algorithm predicts humane endpoint in an intracranial rat glioma model. Sci Rep. 2020 Jun 2;10(1):9020. DOI: 10.1038/s41598-020-65783-7
Berkelmann L, Bader A, Meshksar S, Dierks A, Hatipoglu Majernik G, Krauss JK, Schwabe K, Manteuffel D, Ngezahayo A. Tumour-treating fields (TTFields): Investigations on the mechanism of action by electromagnetic exposure of cells in telophase/cytokinesis. Sci Rep. 2019 May 14;9(1):7362. DOI: 10.1038/s41598-019-43621-9
Wu Z, Nakamura M, Krauss JK, Schwabe K, John N. Intracranial rat glioma model for tumor resection and local treatment. J Neurosci Methods. 2018 Apr 1;299:1-7. DOI: 10.1016/j.jneumeth.2018.02.002
Borrmann N, Friedrich S, Schwabe K, Hedrich HJ, Krauss JK, Knapp WH, Nakamura M, Meyer GJ, Walte A. Systemic treatment with 4-211Atphenylalanine enhances survival of rats with intracranial glioblastoma. Nuklearmedizin. 2013 Dec 13;52(6):212-21. DOI: 10.3413/Nukmed-0580-13-05
Friedrich S, Schwabe K, Grote M, Krauss JK, Nakamura M. Effect of systemic celecoxib on human meningioma after intracranial transplantation into nude mice. Acta Neurochir (Wien). 2013 Jan;155(1):173-82. DOI: 10.1007/s00701-012-1534-7
Friedrich S, Schwabe K, Klein R, Krusche CA, Krauss JK, Nakamura M. Comparative morphological and immunohistochemical study of human meningioma after intracranial transplantation into nude mice. J Neurosci Methods. 2012 Mar 30;205(1):1-9. DOI: 10.1016/j.jneumeth.2011.12.009
Hong B, Krusche CA, Schwabe K, Friedrich S, Klein R, Krauss JK, Nakamura M. Cyclooxygenase-2 supports tumor proliferation in vestibular schwannomas. Neurosurgery. 2011 Apr;68(4):1112-7. DOI: 10.1227/NEU.0b013e318208f5c7
Kooperationen
Prof. Dr. Christian Hartmann (Institut für Neuropathologie, MHH)
Prof. Dr. Thomas Skripuletz (Klinik für Neurologie, MHH)
Prof. Dr. Dirk Manteuffel (Institut für Hochfrequenztechnik, LUH)
Prof. Dr. Anaclet Ngezahayo (Institut für Biophysik, LUH)
Prof. Dr. Hannelore Ehrenreich (Max-Planck-Institut für experimentelle Medizin, Göttingen)
Förderung
DFG Forschungsgruppe 2591 - SCHW1176/7-1
Stiftung Neurochirurgische Forschung