AG Scholz

MAPs Single Molecule Motility Group / Einzelmolekülmotilität von Motorproteinen
Forschungsschwerpunkt
Ein Schwerpunkt der Arbeitsgruppe ist die funktionelle Charakerisierung von Kinesinen, Myosinen und Dynein auf Einzelmolekülebene. Der intrazelluläre Transport z.B. in Nervenzellen, die Trennung der replizierten Chromosomen während der Zellteilung, das Schlagen von Flagellen und Zilien sowie die Muskelkontraktion vielzelliger Lebewesen sind Beispiele für Bewegungen von und in lebenden Organismen. Sie basieren auf der zyklischen Interaktion der Motorproteine Kinesin , Myosin und Dynein mit Strukturproteinen des Zytoskeletts wie Aktin und Tubulin.
Motorproteine der Kinesinfamilie sind Mikrotubuli-aktivierte ATPasen. Sie bewegen sich entlang von Mikrotubuli, röhrenförmigen Strukturen des Zytoskellets. Diese werden aus Protofilamenten gebildet, die durch Polymerisation von α/β-Tubulin-Heterodimeren entstehen. Das konventionelle Kinesin (auch Kinesin-1, Abbildung 1) wurde ursprünglich in Riesenaxonen von Tintenfischen entdeckt, wo es für den Vesikeltransport in die Zellperipherie der Nervenzellen zuständig ist. Im Gegensatz zum muskulären Myosin-2 ist das konventionelle Kinesin ein prozessives Motormolekül. Das heißt, es kann Hunderte von 8 nm langen Schritten, entsprechend der Größe eines α/β-Tubulin-Heterodimers, entlang eines Mikrotubulus machen, ohne von diesem zu dissoziieren. Vermutlich jeder Schritt ist dabei an die Hydrolyse eines Moleküls ATP gekoppelt. Die Fähigkeit von Kinesin, lange Strecken entlang von Mikrotubuli zu wandern, ohne von diesen zu dissoziieren, ist für seine biologische Funktion als Langstreckentransporter äußerst wichtig. Jedoch ist noch nicht im Detail geklärt, wie Kinesinmoleküle ihre beiden Motordomänen dafür koordinieren oder wie die Laufrichtung von Kinesinmolekülen bestimmt wird.
Möglichkeiten zur Untersuchung dieser Fragen bieten hier Messungen auf der Ebene einzelner Moleküle. Eine dafür sehr gut geeignete Technik ist die TIRF- (Total Internal Reflection Fluorescence) oder Evanescent wave Mikroskopie. Mit ihr lassen sich z.B. einzelne fluoreszenzmarkierte ATP- und Motormoleküle detektiertieren und deren Bewegungen verfolgen. So kann die Bewegung einzelner Motormoleküle mit der Bindung und Hydrolyse von fluoreszenzmarkiertem ATP korreliert werden. Diese Assays erlauben uns auch, funktionelle Auswirkungen gezielt eingeführter Mutationen in den Motorproteinen zu charakterisieren. Damit kann die funktionelle Relevanz einzelner Strukturelemente sowie die strukturelle Basis der Kommunikation zwischen den einzelnen Domänen der Motorproteine abgeleitet werden.

Movie 1: Einzelmolekülassay Kinesin-1 auf einem Mikrotubulus
Movie 1 zeigt ein Beispiel für die ATP-getriebenen prozessiven Bewegungen einzelner, fluoreszenzmarkierter Kinesinmoleküle (grün) auf einem immobilisierten, ebenfalls fluoreszenzmarkierten Mikrotubulus (rot).
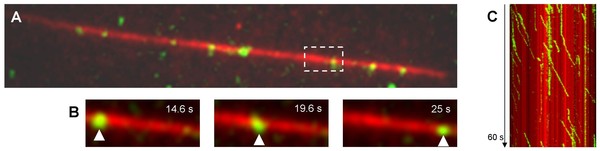
Abb. 2: (A) Momentaufnahme einzelner sich bewegender Kinesin-1 Moleküle (grün) entlang eines immobilisierten markierten Mikrotubulus (Länge 34 µm, rot) in Gegenwart von ATP. (B) Ein einzelnes Kinesinmolekül (grün) bewegt sich prozessiv entlang des immobilisierten Mikrotubulus. (C) Gerichtete Bewegungen der einzelnen Kinesinmoleküle sind in einem Positions-Zeit-Plot (Kymograph) als nach rechts abweichende (grüne) Linien zu erkennen (Laufgeschwindigkeit 500-600 nm/s).
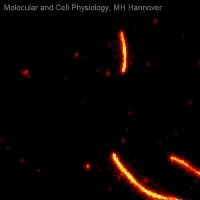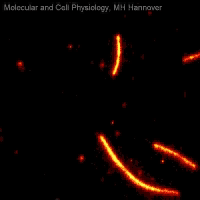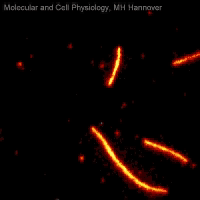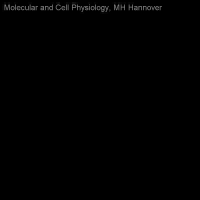
Movie 2: Mikrotubuli-Gleitassay
In Movie 2 ist ein Mikrotubuli-Gleitassay zu sehen, bei dem fluoreszenzmarkierte Mikrotubuli (rot) unter ATP-Verbrauch auf einem Rasen immobilisierter Kinesinmoleküle (nicht sichtbar) bewegt werden.
- Dr. rer. nat. Tim Scholz
- Petra Uta (Medizinischen Technologinnen für Laboratoriumsanalytik)
- Marina Zefi
Wissenschaftliche Arbeiten
Abgeschlossene Qualifiktationsarbeiten und Doktorarbeiten seit 2019
- Zefi, Marina
BSc Biologie, Einfluss von Fluoreszenzmarkierungen und Temperaturen auf die in vitro Gleitgeschwindigkeit von Aktinfilamenten auf kardialen Myosinisoformen des Schweins - Okon, Adrianne
BSc Biologie, Funktionelle Charakterisierung kardialen Myosins mittels eines in vitro Motilitätsassays - Mohebbi, Maral
Dr. med. dent., Einfluss der essentiellen leichten Myosinkette auf die Aktinfilament-Gleitgeschwindigkeit von β-Myosin“. - Heilmann, Pia Louisa
BSc Biologie, Funktioneller Vergleich der Temperaturabhängigkeit kardialer Myosinisoformen unter Verwendung eines in vitro Motilitätsassays - Osten, Jennifer
Dr. rer. nat., Functional characterization of different myosin isoforms and disease-associated mutations in the cardiac β-myosin motor domain - Huhnt, Helen Elisabeth
Dr. med. dent., Auswirkungen der Mutation S456Y in der Schalter-II-Region von Myosin II auf den ATP-Umsatz einzelner Moleküle - Jalal-Ebrahimi, Avesta
Dr. med. dent., Einfluss des Nukleotidstatus von Tubulin auf die Tau-Mikrotubuli-Interaktion - Werkman, Christoph
Dr. med., Funktionelle Auswirkungen der Punktmutation R723G in der Myosin-Kopfdomäne bei familiärer hypertropher Kardiomyopathie Untersuchung am Einzelmolekül mittels optischer Falle - Lesch, Elisa
Dr. med. dent., Auswirkungen der krankheits-assoziierten Tau-Protein-Mutation ΔK280 auf die Kinesinfunktion - Pfeffer, Tobias J.
Dr. med., Inhibition von Krankheits-assoziierten Kinesinmolekülen - Hinrichs, Maike
Dr. rer. nat., Diffusion von Tau auf Mikrotubuli und Auswirkung auf die Kinesin-Funktion - Hanke, Eva
M.Sc., Molekulare Medizin, Establishment of a cardiac in vitro motility test system for the functional characterisation of left ventricular myosin molecules - Jablonski, Janos
B.Sc.Biologie, Direkte Beobachtung des ATP-Umsatzes am individuellen Myosinmolekül mittels TIRF-Mikroskopie - Pliquet, Julia
B.Sc. Biologie, Kinesin 5 ‐ Funktion und Inhibition, eine Einzelmolekülstudie - Koch, Peter
Dipl. Biochemiker, Untersuchung eines Kinesinkonstrukts auf Einzelmolekülebene mittels TIRF-Mikroskopie - Lampe, Marko
Dipl. Biochemiker, Charakterisierung der Fortbewegung von Mikrotubulus-gebundenen Kinesinen auf Einzelmolekülebene mittels Evanescent Field Mikroskopie
Hier finden Sie mehr zum Thema Lehre in der Physiologie für Human- Zahnmediziner, Biologen, Biomediziner oder Biochemiker.
- Rajendraprasad G, Kyriazi D, Franz P, Bader A, Erent M, Uta P, Preller M, Scholz T, Tsiavaliaris G, Long-tailed class I myosins rely on tail-mediated phosphoinositide recognition for specific membrane recruitment, .,Cell Commun Signal. 2025 Dec 4;23(1):519. doi: 10.1186/s12964-025-02528-x. PubMed
- Osten, J., Mohebbi, M., Uta, P., Matinmehr, F., Wang, T., Kraft, T., Amrute-Nayak, M., Scholz, T. (2022) Myosin essential light chain 1sa decelerates actin and thin filament gliding on β-myosin molecules. J Gen Physiol. Oct 3; 154(10):e202213149. Doi: 10.1085/jgp.202213149.
- Wang, T., Spahiu, E., Osten, J., Behrens, F., Gruenhagen, F., Scholz, T., Kraft, T., Nayak, A., Amrute-Nayak, M. (2022) Cardiac ventricular myosin and slow skeletal myosin exhibit dissimilar chemo-mechanical properties despite bearing the same myosin heavy chain isoform. J Biol Chem. 2022 May 24:102070. Doi: 10.1016/j.jbc.2022.102070.
- Amrute-Nayak, M., Nayak, A., Steffen, W., Tsiavaliaris, G., Scholz, T., Brenner, B. (2019) Transformation of the non-processive fast skeletal myosin II into a processive motor. Small. Jan 18:e1804313. Doi: 10.1002/smll.201804313.
- Behrens, V.A., Walter, W.J., Peters, C., Wang, T, Brenner, B., Geeves, M.A., Scholz, T.*, Steffen, W.* (2018) Mg2+-free ATP regulates native cytoplasmic dynein’s processivity. FEBS Letters. Doi: 10.1002/1873-3468.13319. (*geteilte Letztautorenschaft)
- Pfeffer, T.J., Sasse, F., Schmidt, C.F., Lakämper, S., Kirschning, A., Scholz, T. (2016) The natural diterpene tonantzitlolone A and its synthetic enantiomer inhibit cell proliferation and kinesin-5 function. Eur J Med Chem. 112:164-170. Doi: 10.1016/j.ejmech.2016.02.022.
- Scholz, T. # und Mandelkow, E. (2014) Transport and diffusion of Tau protein in neurons. Cell Mol Life Sci. 71, 3139-50. [Epub 2014 Apr 1 as doi: 10.1007/s00018-014-1610-7] (#corresponding author)
- Amrute-Nayak, M., Lambeck,K.-A., Radocaj, A., Huhnt, H.E., Scholz, T., Hahn, N., Tsiavaliaris, G., Walter, W.J., Brenner, B. (2014) ATP turnover by individual myosin molecules hints at two conformers of the myosin active site. Proc Natl Acad Sci USA. 111(7):2536-41. Doi: 10.1073/pnas.1316390111.
- Hinrichs, M.H., Jalal, A., Brenner, B., Mandelkow, E., Kumar, S., Scholz, T. (2012) Tau protein diffuses along the microtubule lattice. J Biol Chem. 287, 38559-68.
- Brenner, B., Hahn, N., Hanke, E., Martinmehr, F., Scholz, T., Steffen, W., Kraft, T. (2012) Mechanical and kinetic properties of β-cardiac/slow skeletal muscle myosin. J Muscle Res Cell Motility. Doi:10.1007/s10974-012-9315-8.
- Rump, A.*, Scholz, T.*, Thiel, C., Hartmann, F.K., Uta, P., Hinrichs, M.H., Taft, M.H., Tsiavaliaris, G. (2011) Myosin-1C associates with microtubules and stabilizes the mitotic spindle during cell division. J Cell Sci. 124, 2521-8. (*geteilte Erstautorenschaft)
- Kommentar in „In this issue: Myosin-1C gives spindles support” J Cell Sci. (2011) 124:e1501.
- Scholz, T., Vicary, J.A., Jeppesen, G.M., Ulcinas, A., Hörber, J.K.H., Antognozzi, M. (2011). Processive behaviour of kinesin observed using micro-fabricated cantilevers. Nanotechnology. 22,095707. Doi: 10.1088/0957-4484/22/9/095707
- Kommentar in Demming, A. “Editorial: Nanodevices come to life” Nanotechnology 22 (2011) 090201 (2pp).
- Radtke, K., Kieneke, D., Wolfstein, A., Michael, K., Steffen, W., Scholz, T., Karger, A., Sodeik, B. (2010). Plus- and Minus-end Directed Microtubule Motors Bind Simultaneously to Herpes Simplex Virus Capsids using Different Inner Tegument Structures. PLoS Pathog 6, e1000991. Doi:10.1371/journal.ppat.1000991.
- Amrute-Nayak, M., Antognozzi, M., Scholz, T., Kojima, H., Brenner, B. (2008). Inorganic phosphate binds to the empty nucleotide binding pocket of conventional myosin II. J Biol Chem. 283, 3773-3781.
- Scholz, T., Altmann, S.M., Antognozzi, M., Tischer, C., Hörber, J.K.H., Brenner, B. (2005). Mechanical properties of single myosin molecules probed with the Photonic Force Microscope. Biophys J. 88, 360-371.
- Becker, N.B., Altmann, S.M., Scholz, T., Hörber, J.K.H., Stelzer, E.H.K., Rohrbach, A. (2005). Three-dimensional bead position histograms reveal single-molecule nanomechanics. Physical Review E. 71, 021907 (7 pages).
- Scholz, T. und Brenner B. (2003). Actin sliding on reconstituted myosin filaments containing only one myosin heavy chain isoform. J Muscle Res Cell Motility. 24, 77-86.
- Köhler, J., Winkler, G., Schulte, I., Scholz, T., McKenna, W., Brenner, B., Kraft, T. (2002). Mutation of the myosin converter domain alters cross-bridge elasticity. Proc Natl Acad Sci USA. 99, 3557-3562.
- Einflüsse des mit der Alzheimer-Krankheit assoziierten Tau Proteins auf die Kinesinfunktion, Mitarbeiter: Müller HS, Jalal A, Uta P; Kooperation: Mandelkow, E, MPI-ASMB, Hamburg; Manstein D, Biophysikalische Chemie, MHH
- Wirkungsmechanismen kleinmolekularer Hemmstoffe auf mitotische Kinesinmoleküle, Mitarbeiter: Pfeffer T; Kooperation: Kirschning A, Institut für Organische Chemie, LUH; Schmidt CF, Georg-August-Universität Göttingen
- Klasse 1 Myosine als Regulatoren von Mikrotubulidynamik und Kinesinfunktion, Mitarbeiter: Uta P; Kooperation: Tsiavaliaris G, Biophysikalische Chemie, MHH
- Mechanische Charakterisierung einzelner Kinesinmoleküle mit dem Lateral Molecular Force Mikroskop und dem Photonischen Kraftmikroskop, Kooperation: Antognozzi M, Hörber H, University of Bristol, UK