Forschung
Untersuchung zur zellulären Aufnahme von C. difficile Toxinen
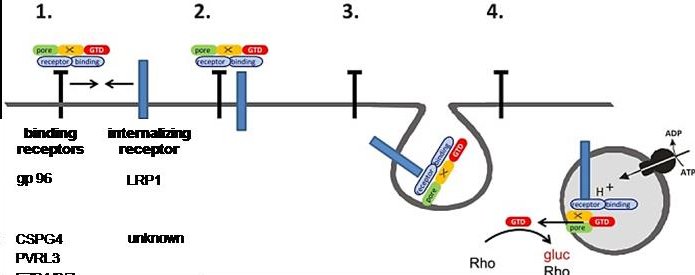
Toxigene Stämme von C. difficile sind Hauptverursacher der Antibiotika-assoziierten Diarrhö sowie ihrer schweren Verlaufsform, der pseudomembrnösen Kolitis. C. difficiole produziert drei Enterotoxine, Toxin A (tcdA), Toxin B (TcdB) sowie das C. difficile Toxin (CDT). TcdA (307 kDa) und TcdB (270 kDa) sind große, einkettige Proteintoxine, die sich mittels Rezeptor vermittelter Endozytose in ihre Zielzellen selbst einschleusen. In der Zelle mono-O-glucosylieren (damit inaktivieren) TcdA und TcdB niedermolekulare GTP bindende Proteine der Rho- und Ras-Familien, in dessen Folge der Barrierefunktion des Kolonepithels und die Kolonerneuerung gehemmt werden. In den letzten 5 Jahren kam Schwung in die Identifizierung der Toxinrezeptoren.
Die Arbeitsgruppe Genth hat kürzlich ein neues 2-Rezeptor-Modell der Toxinaufnahme entwickelt, welches internalisierende und nicht-internalisierende Rezeptoren in der Toxinaufnahme unterscheidet. Die Internalisierung der Toxinrezeptoren untersucht die Arbeitsgruppe, indem die Rezeptoren reversibel an der Zelloberfläche biotinyliert und die Internalisierung der biotinylierten Rezeptoren mittels Temperaturerhöhung induziert wird (Kooperation mit Dr. Robert Lindner, MHH Anatomie). Weitere wichtige Techniken erlauben die Bestimmung der Zelloberflächenbindung der Toxine sowie die Toxin-Rezeptorbindung. Außerdem soll der Endozytosemechanismus identifiziert werden, über den die Toxine das Zytosol der Zielzelle erreichen. Diese Arbeiten erlaubt die Identifizierung von pharmakologischen Zielstrukturen für die Entwicklung von Antitoxinen.
Struktur-Funktionsanalyse von Zytotoxinen aus Chlamydien spp.
Das Gram-negative, intrazelluläre Bakterium Chlamydia trachomatis verursacht akute and chronische Infektionen des Urogenitaltrakts, welche zu Infertilität und ektopischer Schwangerschaft führen können. Das einzige bisher teilweise charakterisierte Zytotoxin CT166 des Chlamydia trachomatis Serovar D zeigt auffällige Ähnlichkeiten zu den C. difficile Toxinen. Dem CT166 verwandte Zytotoxine haben wir in verschiedenen Chlamydia spp. identifiziert. Daher untersucht die Arbeitsgruppe Genth in Kooperation mit Prof. Andreas Klos (MHH Medizinische Mikrobiologie) die biologischen Wirkungen dieser bisher kaum untersuchten Toxinfamilie.
