AG Knochen / Frakturheilung
Frakturen sind in der heutigen Zeit nach wie vor keine Seltenheit. Normalerweise heilen diese komplikationslos ohne Narbenbildung aus. Ist eine Fraktur jedoch nach vier Monaten nicht vollständig knöchern überbrückt, liegt eine Frakturheilungsstörung oder eine verzögerte Frakturheilung („delayed union“) vor. Findet auch nach sechs Monaten keine stabile Überbrückung statt, spricht man von einer Pseudarthrose („non-union“). Die Gründe für eine verzögerte oder nicht stattfindende Frakturheilung sind vielfältig. Die häufigsten Ursachen sind:
- eine mangelhafte Durchblutung z.B. durch fehlende Gefäßversorgung, wodurch eine Knochennekrose entsteht,
- eine nicht ausreichende Stabilisierung der Fraktur, sodass eine zu große Beweglichkeit im Frakturspalt herrscht,
- ein mangelnder Kontakt der Knochenfragmente
- oder Komorbiditäten, wie Infektionen, Alter, Alkoholkonsum, Rauchen, Osteoporose oder ein Polytrauma.
Daher werden in der Arbeitsgruppe „Knochen/Frakturheilung“ verschiedene mögliche Ursachen für Frakturheilungsstörungen und Pseudarthrosen untersucht. Da eine Standardisierung und Gewinnung von Knochenproben im klinischen Kontext nur schwer zur erreichen ist, werden häufig Tiermodelle genutzt. Das übergeordnete Ziel dabei ist jedoch stets die zugrundeliegenden Mechanismen der Frakturheilungsstörungen besser zu verstehen, um Risikopatienten frühzeitig identifizieren und neue Therapien entwickeln zu können.
Frakturen gehen aufgrund von Gefäßverletzungen häufig mit einem schweren Blutverlust einher, und klinische Studien belegen, dass die Heilung von Knochenbrüchen bei Patienten, die zusätzlich einen schweren Blutverlust erlitten haben, gestört und verzögert sein kann. Daher stellt die Untersuchung der Auswirkung eines solchen schweren Blutverlust auf die Frakturheilung ein besonders wichtiges Thema dar.
Im Mausmodell konnte unsere Forschergruppe bereits zeigen, dass in jungen gesunden Mäusen ein schwerer Blutverlust einen negativen Effekt auf die Knochenregeneration nach Fraktur hat. Dies konnte sowohl makroskopisch, als auch in Röntgenaufnahmen und µCT-Scans belegt werden. Auch die Biomechanik der Knochen zeigte ein reduziertes Maximales Biegemoment im 3-Punkt-Biegetest und histologisch war weniger Knochen und Knorpel mit schwerem Blutverlust im Frakturspalt nachweisbar verglichen mit einer isolierten Fraktur. Außerdem fanden wir mittels PCR Arrays, qRT-PCR mit TaqMan Assays und Western Blot-Analysen heraus, dass der Wnt-Signalweg durch den schweren Blutverlust stark beeinträchtigt wird. Dieser ist wichtig für den Knochenstoffwechsel und sowohl am Knochenauf-, als auch -abbau beteiligt, sodass die Inhibierung auch in diesem Modell zu einer verzögerten Knochenheilung führte. Da der durchschnittliche Patient jedoch nicht jung und meist zusätzlich zu den Traumata häufig noch alkoholisiert ist, wurde dieses Mausmodell eines schweren Blutverlusts in Kombination mit einer Fraktur unter anderem auch unter Alkoholeinfluss und/oder in Kombination mit einem hohen Alter eingesetzt.
Haben Sie Fragen oder Anregungen, oder sind Sie interessiert in unserem Labor eine Master- oder Doktorarbeit zu schreiben, dann nehmen Sie bitte Kontakt mit uns auf!
Tel: +49 511 532-84246
Bundkirchen.Katrin@mh-hannover.de
Frakturheilung in der Maus
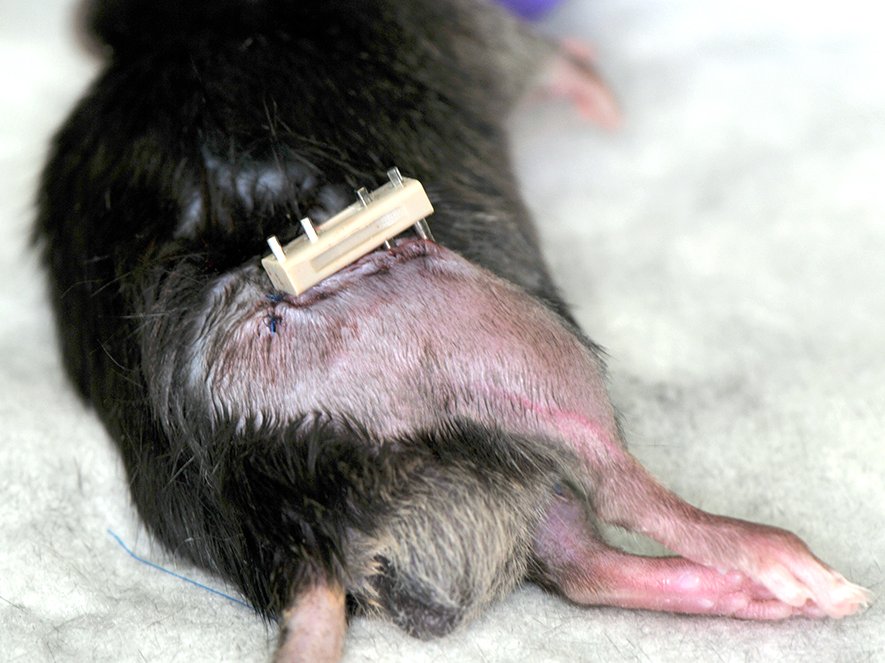
Ein etabliertes und auch von uns verwendetes Model in der Frakturheilungsforschung ist die Stabilisierung eines Knochenbruchs mittels externen Fixateur, der auch in der humanen Klinik Anwendung findet.
Radiologische Auswertung
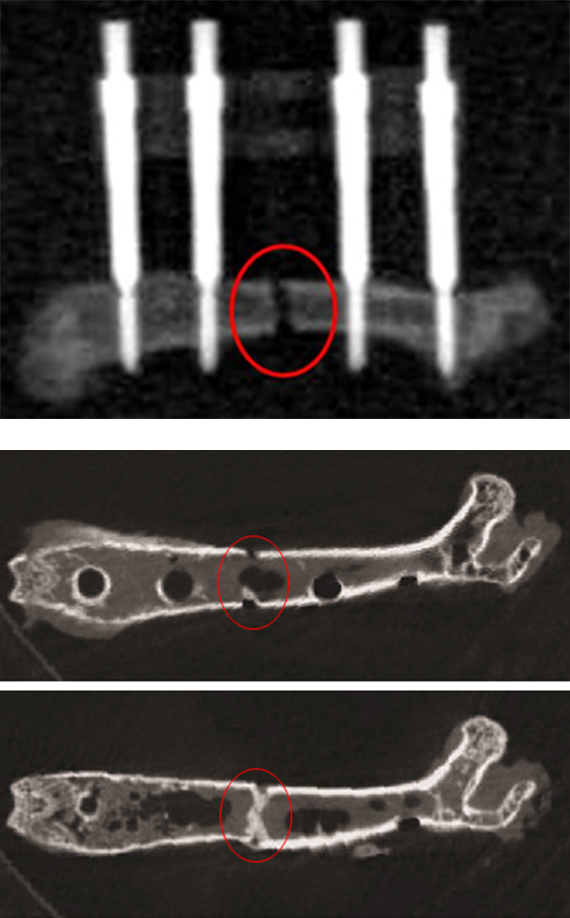
A) Röntgenaufnahme eines zuvor frakturierten Knochens inklusive eingebrachtem Fixateur extern.
B) µCT-Scans nach Ausbau der externen Fixierung. Der rote Kreis markiert jeweils die Fraktur.
Histologische Auswertung
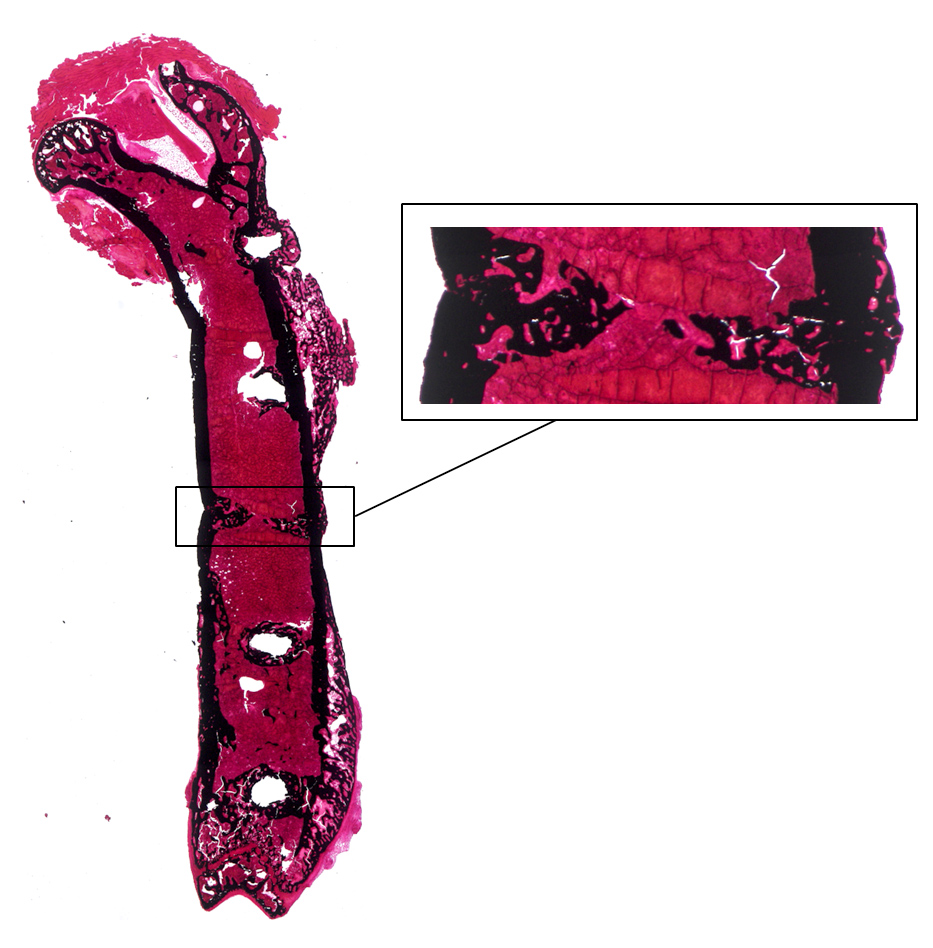
Mittels von Kossa/Safranin O-Färbung kann der mineralisierte Knochen im Frakturspalt ausgewertet werden. Dieser stellt sich in schwarz dar, während alle anderen Gewebearten wie Knochenmark, Bindegewebe und Muskulatur in unterschiedlichen Rottönen angefärbt sind.
Biomechanische Auswertung

Die Knochen werden mittels 3-Punkt-Biegetest analysiert. Dafür werden sie in anteroposteriorer Ausrichtung auf eine eigens dafür designte Apparatur gelegt. Von oben drückt ein Stempel bis zum Strukturversagen auf die Probe.
