Weitere Nachrichten auf der Startseite
In vivo Genkorrektur bei hereditärer Hämochromatose
Die angeborene Hämochromatose vom Typ 1 gehört mit einer Prävalenz 0,2 - 0,4% zu den häufigsten angeborenen Stoffwechselerkrankungen im europäischen Raum.
In über 80 % der Fälle liegt eine homozygote C282Y-Mutation im HFE-Gen vor, welche eine Fehlfaltung des HFE Proteins verursacht. Dies wiederum hat eine gestörte Expression von Hepcidin zur Folge, das den Abbau des Membranproteins Ferroportin auf den Enterozyten kontrolliert.
Somit kommt es durch eine erhöhte intestinale Eisenresorption zu einer systemischen Eisenüberladung in mehreren Organen, die in der Folge Leberzirrhose, Kardiomyopathie und Diabetes mellitus (Bronzediabetes) verursachen kann. Eine der wichtigsten Komplikationen der hereditären Hämochromatose ist das hepatozelluläre Karzinom. Treten gleichzeitig Leberschädigungen anderer Genese auf, so ist das Risiko für eine chronische Leberschädigung mit Fibrosierung deutlich erhöht.
Durch ihren langsamen und über lange Zeit asymptomatischen Verlauf manifestiert sich die hereditäre Hämochromatose häufig erst zwischen dem 40. und 60. Lebensjahr, insbesondere bei Männern, jedoch entwickeln nicht alle Träger dieser Mutation zwangsläufig eine Erkrankung (unvollständige Penetranz).
Die Therapie der hereditären Hämochromatose besteht in lebenslangen Aderlässen, um die Eisenkonzentration im Körper zu normalisieren. Beginnt diese Therapie noch vor der Manifestation der Leberzirrhose, so lassen sich Organschäden bei vielen Patienten abwenden. Medikamentös können Chelatbildner, wie Deferoxamin, eingesetzt werden, die jedoch ein hohes Nebenwirkungspotenzial aufweisen.
Mit der Entwicklung der CRISPR/Cas Technologie wurde ein Meilenstein in der biotechnologischen Forschung gesetzt. Die molekulare Genschere erlaubt es, präzise DNA-Doppelstrangbrüche im Genom einer Zelle zu erzeugen. Die anschließende, weitaus weniger präzise Reparatur durch spezielle zelluläre Enzyme, auch non-homologous end joining genannt, führt dann zu einer Unterbrechung der jeweiligen Gensequenz, was die klassische CRISPR/Cas Technologie im Labor zu einem nützlichen Werkzeug für die Ausschaltung von Genen macht.
Deutlich schwieriger gestaltet sich allerdings die Korrektur einer Punktmutation oder gar das passgenaue Einfügen einer speziellen Gensequenz in das Genom. Bei dem sogenannten Base Editing kommt es im Gegensatz zum klassischen CRISPR/Cas nicht mehr zu einem DNA-Doppelstrangbruch, sondern zum gezielten Austausch eines einzelnen Nukleotids - mit hoher Effizienz.
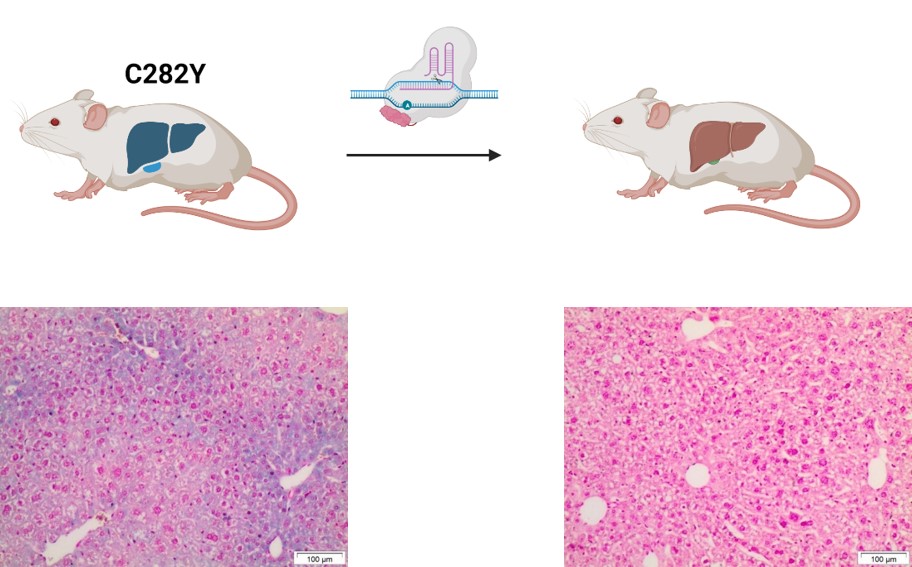
Mithilfe eines solchen neuartigen Base Editors ist es uns gelungen, die C282Y Mutation in vivo in einem Hämochromatose Mausmodell zu korrigieren. Zunächst wurde der Baseneditor so konfiguriert, dass er die korrekte „Adresse“ im Genom findet und effizient editiert. Anschließend wurden Adeno Assoziierte Virale (AAV) Vektoren genutzt, um den Base Editor in die Hepatozyten einzuschleusen. Bereits nach einmaliger Applikation zeigten sich signifikante Verbesserungen der Eisenparameter.
Am Beispiel der Hämochromatose konnten wir eine effiziente in vivo Korrektur der häufigsten Mutation in Europa demonstrieren. Aktuell arbeiten wir am Einsatz nicht-viraler Vektoren, um zukünftig eine zusätzliche Therapieoption für schwere Verläufe dieser und anderer Stoffwechselerkrankungen bereitzustellen.
Weiter Informationen erhalten Sie bei Dr. Simon Krooss (krooss.simon@mh-hannover.de, 0511-532 7128) und Prof. Dr. Michael Ott (Ott.Michael@mh-hannover.de, 0511-532 7120).
Die Originalarbeit mit der Erstautorin Dr. Alice Rovai wurde in der renommierten Fachzeitschrift Nature Communications veröffentlicht.
