AG Epigenomik
Leitung: Dr. rer. nat. Britta Skawran
„Das hepatozelluläre Karzinom (HCC) ist ein hochmaligner Tumor mit eingeschränkten Therapiemöglichkeiten. Für die Auswahl neuer therapeutischer Zielstrukturen ist das Verständnis der molekularen Mechanismen der Hepatokarzinogenese von großer Bedeutung. Es ist seit kurzem bekannt, dass für die Entstehung eines Tumors und seine Progression (Fortschritt) nicht nur genetische Veränderungen innerhalb der Zelle ursächlich sind, sondern dass auch epigenetische Merkmale wie die Histonacetylierung gestört sind.“, Britta Skawran
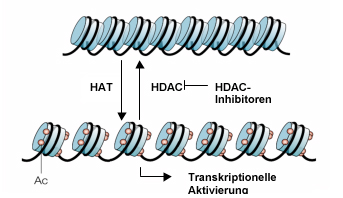
Modell für die Regulation des chromatin remodelling und der transkriptionellen Aktivität, vermittelt durch reversible Histonacetylierung; modifiziert nach (P. A. Marks et al., 2001)
Die Acetylierung (Ac) der Lysinreste der aminoterminalen Enden von Histonproteinen lockert den Kontakt zwischen Histonproteinen und DNA und führt so zur transkriptionellen Aktivierung in den betreffenden Bereichen. Hemmung der Histondeacetylasen HDACs durch HDAC-Inhibitoren führt zu Hyperacetylierung.
Mitarbeiter/innen
-
Dr. rer. nat. Beate Vajen, Post-Doc
-
Marlies Eilers, MTA
-
Vera Schäffer, Biologielaborantin
Unser Forschungsziel
Unser Ziel ist es, durch Histondeacetylierung bzw. -acetylierung die funktionellen Konsequenzen alterierter mRNA und miRNA Expression für Entwicklung und Progression des HCC aufzuklären.
In vorangegangenen Studien konnten wir zeigen, dass mehrere Histondeacetylasen im HCC signifikant überexprimiert sind. Es ist bekannt, dass die Alteration der Histonacetylierung in humanen Tumorzellen zur veränderten Transkription von Genen und miRNAs führt. Mittels Zellkulturarbeiten und modernen molekularbiologischer Methoden wie der Array-CGH, den Expressionsanalysen und der Proteomics, können wir deregulierte Signalwege in der Zelle identifizieren, und eventuell Angriffspunkte für neue therapeutische Optionen finden.
Unsere Forschungsschwerpunkte
In humanen Tumorzellen ist die Chromatinstruktur weiter genomischer Bereiche durch epigenetische Modifikation, wie z.B. Histonmethylierung oder Histonacetylierung, verändert. Der Verlust des Acetylrestes durch Histondeacetylasen (HDAC) führt zu einer starken Kondensation des Chromatins, was mit einer Inhibition (Blockade) der Transkription einhergeht. So führt die Alteration (Veränderung) der Histonacetylierung zu veränderter Transkription von Genen und miRNAs, die Proliferation (Wachstum), Apoptose (programmierter Zelltod), Differenzierung und genetischen Stabilität regulieren. Schon 2005 konnte Fraga et. al. dem Verlust der Acetylierung am Lysin 16 des Histon H4 eine fundamentale Funktion bei der Krebsentstehung zuschreiben.
Seit kurzem ist weiterhin bekannt, dass die Expression von microRNAs durch Histonmodifikationen stark beeinflusst wird.
Gegenstand unserer Forschung sind die epigenetischen Veränderungen beim HCC. Dabei interessiert uns vor allem, in welchem Kontext sie stehen und welche Bedeutung sie für die maligne Zelltransformation haben. Wir untersuchen am Zellkultursystem die Wirkung alterierender Histonacetylierung. Dabei stehen die tumorsuppressiven und onkogenen Eigenschaften epigenetisch beeinflusster Gene und miRNAs im Fokus.