Hintergrund
Die Forschungsgruppe Molekulare Psychiatrie befasst sich schwerpunktmäßig mit Fragen der Neuroepigenetik.
Epigenetische Mechanismen dienen der Regulation der genetischen Aktivität und sind teilweise vererblich. Durch DNA-Methylierung und posttranslationale Modifikation von Histonproteinen kann die Struktur der DNA so verändert werden (Chromatin Remodeling), dass einzelne Gene dauerhaft ausgeschaltet sind. Kurze RNA-Spezies und posttranskriptionale RNA-Veränderungen (RNA editing; Alternatives Spleißen) sind weitere Substrate epigenetischer Prozesse.
Für die Psychiatrie konnten in den letzten Jahren die besondere Bedeutung von epigenetischen Prozessen sowohl in der Krankheitsentstehung, der Aufrechterhaltung und Heilung psychischer Erkrankungen gezeigt werden, ebenso aber auch für die biologische Kodierung von Krankheitsempfänglichkeit (Vulnerabilität) oder –unempfänglichkeit (Resilienz). Besonders interessant sind epigenetische Prozesse auch für die Transmission von psychischen Erkrankungen über mehrere Generationen.
Zur Erforschung dieser Phänomene setzen wir im Labor für Molekulare Neurowissenschaften neben dem gesamten Spektrum molekularbiologischer Methoden auch moderne zellbiologische und biochemische Verfahren ein. Die Untersuchung epigenetischer Prozesse von der Zellkultur über passende Tiermodelle bis hin zu klinischen Studienpopulationen entspricht dabei unserem Leitbild der translationalen Forschung.
Innerhalb der Klinik für Psychiatrie, Sozialpsychiatrie und Psychotherapie bestehen enge Kooperationen mit den Arbeitsgruppen
Übergeordnete Ziele
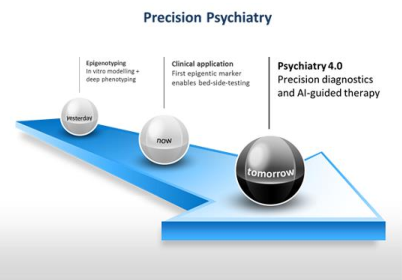
Eines der Haupthindernisse in der heutigen psychiatrischen Forschung ist die offensichtliche Diskrepanz zwischen den diagnostischen Kategorien, die hauptsächlich am Ende des 19. Jahrhunderts geprägt wurden, und den modernen neurobiologischen Konzepten normaler und gestörter Gehirnfunktion, was zu einer Verzögerung bei der Entwicklung neuer und wirksamerer Therapien führt.
Einen Ansatz, diese Kluft zu überwinden, bietet die „personalisierte“ oder „präzise“ Psychiatrie („precision psychiatry“), die auf der Basis eines bio-psychosozialen Krankheitsmodells homogenere Subgruppen von psychisch Erkrankten identifizieren und diese spezifischen Therapien zuführen wird. Ein Hauptforschungsziel unserer Forschungsgruppe ist in diesem Zusammenhang die Verwendung epigenetischer Marker zur Erkennung und Kategorisierung biologisch unterschiedlicher Untergruppen psychiatrischer Störungen, wobei das Ansprechen auf spezifische Therapien als primärer Phänotyp verwendet wird. Sobald ein potenzieller Marker entdeckt wird, widmen wir uns nicht nur der rigorosen Replikation in klinischen Kohorten, sondern versuchen auch zu verstehen, wie eine spezifische Regulation eines bestimmten Gens zu einer (Nicht-) Reaktion auf bestimmte Therapien führt. Um diese Fragen zu beantworten, verwenden wir neben Tier- und Zellkulturmodellen von Patienten stammende Proben einschließlich induzierter pluripotenter Stammzellen (iPSC) sowie post mortem Hirngewebe und nutzen ein breites Spektrum modernster molekularer Untersuchungsmethoden.
Unsere molekularen Befunde ergänzen bildgebende, psychopathologische, testpsychologische und weitere klinische Daten der Patient*innen, denn selbst die besten molekularen Analysen bei psychiatrischen Störungen müssen von der Klinik informiert werden und sollten anschließend wieder in die Klinik übertragen werden können. Um diesen Fluss zu ermöglichen, werden große Kohorten von Patienten mit ausgezeichneter und multimodaler Phänotypisierung benötigt. Eine Möglichkeit, diese Kohorten zu rekrutieren, ist die Etablierung eines broad-consent-Systems, das die Verwendung aller routinemäßig erhobenen klinischen Daten erlaubt. Durch die Einrichtung eines Data-Warehouse-Systems können alle Daten aus den klinischen Informationssystemen für spezifische Forschungsfragen verwendet werden.
Wir haben dieses System durch große Patientenregister für spezielle Indikationen (zum Beispiel ein Register für die Spezialambulanz, die Patienten mit Prader-Willi-Syndrom und psychiatrischen Störungen behandelt) oder Therapien (Niedersächsisches EKT-Outcomeregister - NEKTOR) bzw. Nebenwirkungen (AMSP; Pharmakovigilanz in der Gerontopsychiatrie) ergänzt und um Biobanking von Blut und anderen Proben nach strengen prä-analytischen Protokollen erweitert. Um eine hohe Qualität der phänotypischen Daten zu erreichen, haben wir standardisierte Diagnose- und Behandlungsalgorithmen implementiert. Diese Algorithmen können leicht angepasst werden, um neue Erkenntnisse aufzunehmen (zum Beispiel potenzielle neue Biomarker, die die Behandlung leiten). Gleichzeitig eröffnen große Patient*innenkollektive die Möglichkeit, neue Befunde aus der Grundlagenforschung wie z.B. strukturelle Variationen des Genoms bei Menschen, die an Psychosen leiden, nachzuvollziehen und durch eine multimodale reverse Phänotypisierung besser zu verstehen und klinisch nutzbar zu machen.
Große Datenmengen aus den verschiedenen Bereichen der Grundlagenforschung (-omics, Bildgebung) oder der klinischen Forschung enthalten eine Fülle von Informationen. Zusätzlich führen Neuentwicklungen in der Sensortechnik (z.B. durch Wearables) oder App-basierter Untersuchungen sowie die Möglichkeit, sämtliche klinische Daten aus der Routineversorgung zu verwenden, zu einer noch umfangreicheren Menge an Daten, die mit klassischen Auswertungsmethoden der Inferenzstatistik nicht mehr gehandhabt werden können. Um auf diese Informationen zugreifen zu können, sind neue Methoden zur Datenanalyse wie die Mustererkennung basierend auf künstlicher Intelligenz / neuronalen Netzwerken notwendig.
In den letzten Jahren haben wir Erfahrung in der Verwendung dieser „Big-Data“ -Methoden für die integrative Analyse molekularer und klinischer Daten gesammelt. Die Verwendung von selbstlernenden Algorithmen hilft nicht nur, neue und unerwartete Beziehungen zwischen molekularen und klinischen Daten zu entdecken, sondern fördert auch die Entwicklung von Diagnose- und Behandlungsalgorithmen auf iterative und evolutionäre Weise (Plan-Do-Check-Act (PDCA) –Zyklus zur Integration von Patientenversorgung und Forschungszielen) und ebnet so den Weg für eine präzisere Psychiatrie.
Wir konnten DNA-Methylierungsmarker identifizieren, die auf ein erhöhtes Risiko für ein Nicht-Ansprechen auf monoaminerge Standard-Antidepressiva (EU- und US-Patent erteilt)
oder für ein Nicht-Ansprechen unter Elektrokrampftherapie (EKT) hinweisen. Weitere DNA-Methylierungsmarker, die eine positive Reaktion auf EKT bzw. spezifische psychotherapeutische Behandlungen vorhersagen, werden derzeit getestet.
Ausgewählte Publikationen:
- Lieb, K., Dreimüller, N., Wagner, S., Schlicht, K., Falter, T., Neyazi, A., Müller-Engling, L., Bleich, S., Tadić, A., & Frieling, H. (2018). BDNF Plasma Levels and BDNF Exon IV Promoter Methylation as Predictors for Antidepressant Treatment Response. Frontiers in psychiatry, 9, 511. DOI
- Moschny, N., Zindler, T., Jahn, K., Dorda, M., Davenport, C. F., Wiehlmann, L., Maier, H. B., Eberle, F., Bleich, S., Neyazi, A., & Frieling, H. (2020). Novel candidate genes for ECT response prediction-a pilot study analyzing the DNA methylome of depressed patients receiving electroconvulsive therapy. Clinical epigenetics, 12(1), 114. DOI
Zur Gewinnung von freier DNA aus Liquor von an einer schizophrenen Psychose erkrankten Patienten wurde eine Methode zur Extraktion geringer Mengen DNA aus größeren Liquor-Volumina etabliert. Diese DNA wir aktuell hinsichtlich potentieller Veränderungen der Methlylierungsmuster im Promotorbereich bestimmter Zielgene untersucht.
Das Prader-Willi-Syndrom (PWS) ist eine seltene genetische Erkrankung. Menschen mit PWS leiden deutlich häufiger unter psychischen Erkrankungen, insbesondere Psychosen, als die sogenannte „Normalbevölkerung“. Im Rahmen mehrere Forschungsvorhaben wird ein Register aufgebaut und die molekularbiologischen Ursachen der Entstehung von psychischen Erkrankungen bei PWS erforscht. Weiterhin werden klinische Fragestellungen, bspw. die Etablierung neuer Therapieoptionen, untersucht.
Ungeachtet der bedeutenden evolutionären Funktionen der Nozizeption, kann eine Fehlregulation zur Hypersensitivität der Schmerzempfindung führen. Zur Aufdeckung der zugrunde liegenden regulativen Mechanismen werden sowohl Analysen der Promotor-Methylierung an der Nozizeption beteiligter Gene von Probanden mit unterschiedlicher Schmerzsensitivität durchgeführt, als auch verschiedene molekularbiologische Methoden zur Analyse der Expression und der Promotoraktivität angewendet.
Ausgewählte Publikationen:
- Gombert S, Rhein M, Eberhardt M, Münster T, Bleich S, Leffler A, Frieling H. Epigenetic divergence in the TRPA1 promoter correlates with pressure pain thresholds in healthy individuals. Pain. 2017 Apr;158(4):698-704. PMID: 28030472. DOI
- Achenbach J, Rhein M, Gombert S, Meyer-Bockenkamp F, Buhck M, Eberhardt M, Leffler A, Frieling H, Karst M. Childhood traumatization is associated with differences in TRPA1 promoter methylation in female patients with multisomatoform disorder with pain as the leading bodily symptom. Clin Epigenetics. 2019 Aug 28;11(1):126. PMID: 31455424; PMCID: PMC6712620. DOI
- Gombert S, Rhein M, Winterpacht A, Münster T, Hillemacher T, Leffler A, Frieling H. Transient receptor potential ankyrin 1 promoter methylation and peripheral pain sensitivity in Crohn's disease. Clin Epigenetics. 2019 Dec 31;12(1):1. PMID: 31892361; PMCID: PMC6938615. DOI
Wissenschaftliche Kollaborationen
Neben den bereits oben genannten abteilungsinternen Kooperationen, arbeiten wir im Rahmen von nationalen und internationalen Forschungsverbünden (z.B. bzgl. Esstörungen [BMBF-EDNET], Borderline-Persönlichkeitsstörungen, Psychopharmakowirkung [BMBF-NeSSy] und Traumatisierung) mit zahlreichen weiteren Forschungsgruppen zusammen:
- Institut für Humangenetik
- Institut für Klinische Biochemie
- Institut für Virologie
- Klinik für Augenheilkunde
- Klinik für Anästhesiologie
- Klinik für Hals-Nasen-Ohrenheilkunde
- Klinik für Neurologie mit klinische Neurophysiologie
- Klinik für Neurochirurgie
- LEBAO
- Forschungsverbund zu Essstörungen (BMBF-EDNET)
- Forschungsverbünde zu Borderline-Persönlichkeitsstörung und Psychopharmakawirkung (BMBF-NeSSy)
- Forschungsverbund zu den Neurobiologischen Grundlagen von Pädophilie und sexuellem Missbrauchsverhalten gegen Kinder (BMBF-NeMUP)
- Centre Paul Broca, Paris
- INSERM (Centre Hospitalier Sainte Anne), Paris
Forschungsgruppenmitglieder
Leitung der Forschungsgruppe
Prof. Dr. med. Helge Frieling
Stellvertretender Klinikleiter
Telefon: +49 511 532 7275
Fax: +49 511 532 7276
Telefon: +49 511 532 7275
Telefax: +49 511 532 7276
buchholz.vanessa@mh-hannover.de
Forschungsschwerpunkte: Epigenetische Analysen mittels Sanger
Publikationen: Pubmed
Telefon: +49 511 532 7275
Telefax: +49 511 532 7276
burkert.alexandra@mh-hannover.de
Forschungsschwerpunkte:
- Methylierungsspezifische Sonden-basierte qPCR
- Epigenetische Analysen mittels Sanger-/Nanopore-Sequenzierung
Publikationen: Pubmed
Telefon: +49 511 532 3167
Telefax: +49 511 532 3168
eberlein.christian@mh-hannover.de
Forschungsschwerpunkte:
- Erforschung neurobiologischer Grundlagen der Entstehung psychischer Erkrankung bei Menschen mit dem Prader-Willi-Syndrom.
- Versorgungsforschung, klinische Forschung (Art, Häufigkeit und Symptome psychischer Erkrankung) sowie Erforschung neuer medikamentöser Therapieoptionen bei psychischen Erkrankungen bei Menschen mit dem Prader-Willi-Syndrom.
- Versorgungsforschung, klinische Forschung zu psychischen Erkrankungen bei seltenen syndromalen Erkrankungen (Art, Häufigkeit, Symptome) und Erforschung von medikamentösen und nicht-medikamentösen Therapieoptionen
Publikationen: Pubmed
Telefon: +49 511 532 7245
Telefax: +49 511 532 7276
Forschungsschwerpunkte:
- Epigenetische Analysen mittels Sanger-Sequenzierung
- Studien der Promotoraktivität mittels Luciferase reporter assay
- Expressionsanalysen über RT-qPCR und Western blot
Titel der Doktorarbeit: Epigenetische Regulation des Ionenkanals TRPA1 im Kontext der Druckschmerzsensitivität
Publikationen: Pubmed
Telefon: +49 511 532 7275
Telefax: +49 511 532 7276
Forschungsschwerpunkte:
Erkrankungen:
- Schizophrenie (Biomarker Liquor)
- Sexuelle Deviationen/Paraphilien
- Depression
Methoden:
- Epigenetische Analysen mittels Sanger-/NGS-/Nanopore-Sequenzierung
- Neuronale in-vitro Modelle zur Visualisierung der Synapsenbildung
- Patch Clamp, Calcium Imaging
Publikationen: Pubmed
Telefon: +49 511 532 7275
Telefax: +49 511 532 7276
Forschungsschwerpunkte:
- Epigenetische Regulation von BDNF IV bei antidepressiver Behandlung
- Etablierung eines Gen-Panels bzgl. des Therapieansprechens auf eine antidepressive Behandlung
- Wirkung von Antidepressiva auf die BDNF-Sekretion durch Neuronen und die Wiederaufnahme durch Astrozyten
- Untersuchung der Chromatinzusammensetzung des GDNF-Promotors um dessen Rolle beim Therapieansprechen der Depression zu untersuchen
Publikationen: Pubmed/Pathak_Hansi & PMID21734725 & PIMD28887651
Co-Leiter der Forschungsgruppe "Alkohol-, Nikotin- und Medikamentenabhängigkeit"
Telefon: +49 511 532 7245
Telefax: +49 511 532 7276
Exzellenz auf einem Blick:
- Proteinbiochemie
- Epigenetische Analyseverfahren
- Erforschung der Alkoholabhängigkeit und anderer stofflichen Drogen
- Regulation von Genen in Blut und Gehirn
Publikationen: Pubmed
Deest-Gaubatz.Stephanie@mh-hannover.de
Forschungsschwerpunkte: Schizophrenie-Forschung
