AG Martin
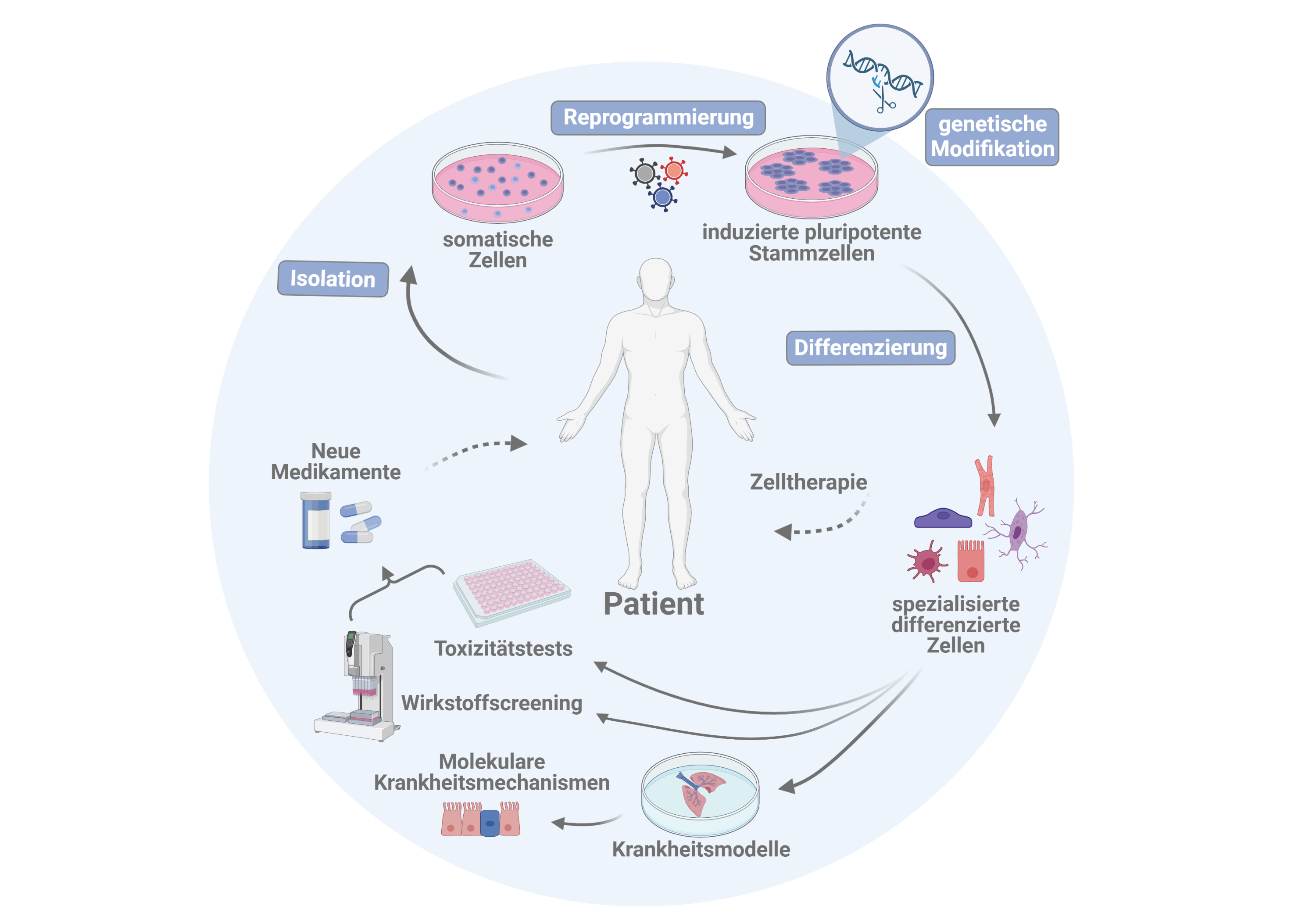
Mit der Perspektive einer möglicherweise auch individualisierten zell-und gentherapeutischen Behandlung von Herz- und Lungenerkrankungen, aber auch zur Erforschung von Krankheitsmechanismen, zur Entwicklung neuer pharmakologischer Wirkstoffe sowie zur Entwicklung von Alternativmethoden zu Tierversuchen werden in der AG Martin folgende Forschungsschwerpunkte adressiert:
- Reprogrammierung somatischer Zellen zu klinisch nutzbaren induzierten pluripotenten Stammzellen (iPS-Zellen)
- Herstellung von patienten-bzw. krankheitsspezifischen iPS-Zelllinien
- Gezielte genetische Modifikation von iPS- Zellen und daraus differenzierter Derivate
- Optimierte Steuerung von vaskulären und respiratorischen Differenzierungsvorgängen von iPS-Zellen zur Entwicklung von organotypischen in vitro Krankheitsmodellen
- Untersuchung zu Sicherheitsaspekten von Zelltherapien
- Entwicklung von Methoden zur in vivo Korrektur krankheitsspezifischer Mutationen über das „Gene Editing“
1. Reprogrammierung somatischer Zellen zu klinisch nutzbaren iPS-Zellen
In der AG Martin stellt die Reprogrammierung somatischer Zellen unterschiedlicher Spezies inzwischen eine Standardmethode dar, die dennoch stetig weiter optimiert wird.
Typischerweise erfolgt die Reprogrammierung differenzierter somatischer Zellen zu iPS-Zellen über Einführung einer definierten Kombination verschiedener zellulärer Faktoren (Reprogrammierungsfaktoren), meist mit Hilfe so genannter viraler Vektoren. Die Einführung von Reprogrammierungsfaktoren in differenzierte Zellen bewirkt eine Reihe genetischer Ereignisse, mit Änderung des DNA-Methylierungs- und des Chromatinstatus, was zur Modifikation der Genexpression und schließlich zur Rückführung/Umwandlung der ausdifferenzierten, somatischen Zelle in einen pluripotenten Zustand führt.
Im Forschungsschwerpunkt Reprogrammierung ist ein Ziel der AG Martin die Entwicklung klinisch anwendbarer Protokolle zur effizienten Generierung von iPS-Zellen. Um die Sicherheit zukünftiger potenzieller klinischer Anwendung von iPS-basierten regenerativen Zelltherapien zu gewährleisten verbessern wir kontinuierlich unsere Protokolle zur Herstellung von GMP-konformen iPS-Zell-Produkten weiter.
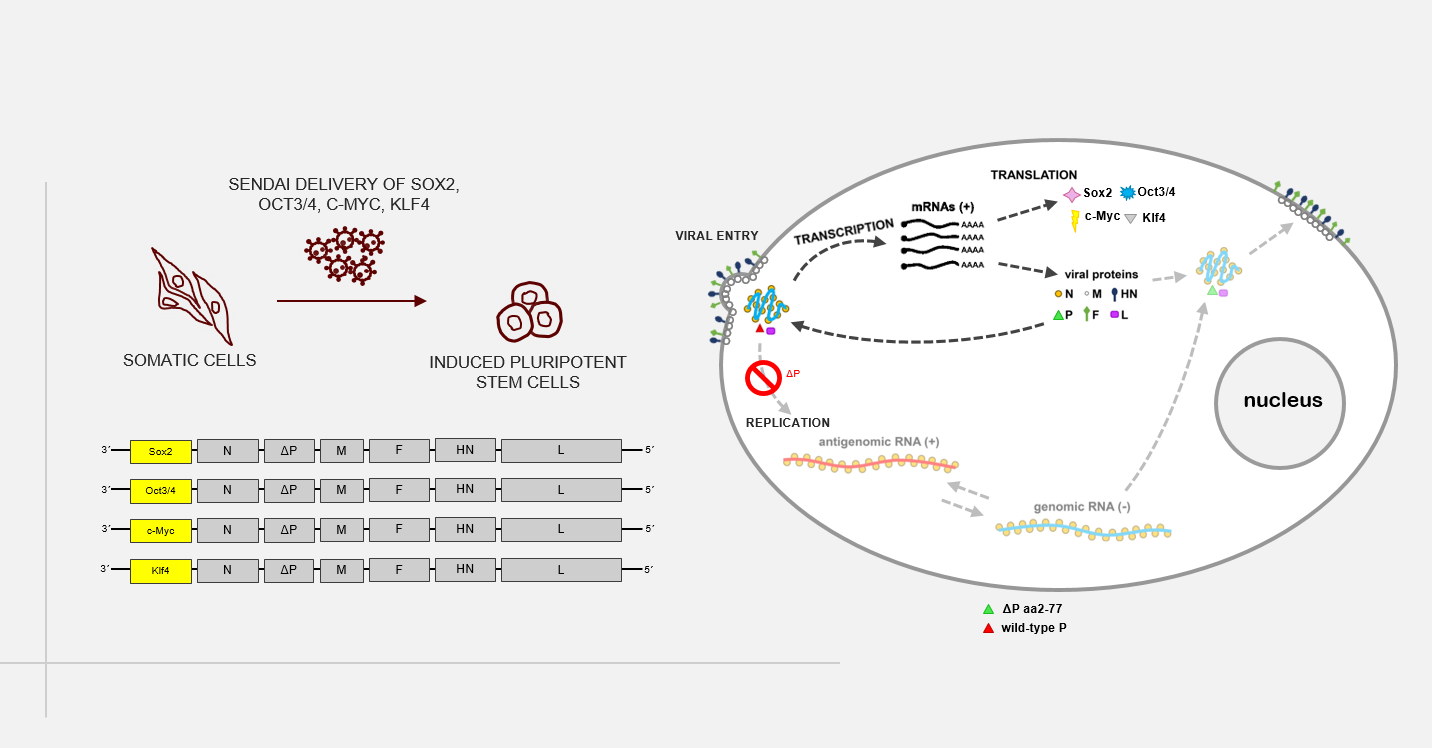
Als alternative, transgenfreie Methode zur Reprogrammierung, um die potenzielle Aktivierung von Protoonkogenen und die Bildung von Teratomen (Keimzelltumoren) zu Verhindern finden inzwischen z.B. synthetische mRNAs oder nichtintegrierenden RNA-Vektoren basierend auf Sendaiviren Verwendung. Als weiteren Sicherheitsaspekt für die therapeutische Anwendbarkeit von iPS-Zellen und deren Derivate etablieren wir in der AG Martin ein eigenes verbessertes Sendai-Virus-Vektor-System zur Übertragung der Reprogrammierungsfaktoren und zur gezielten genetischen Modifikation von therapeutisch einsetzbaren Zellen (siehe auch "6.Entwicklung von Methoden zur in vivo Korrektur krankheitsspezifischer Mutationen über das „Gene Editing“).
A novel, replication-deficient Sendai virus vector system for the generation of induced pluripotent stem cells
Commercially available reprogramming vectors based on Sendai RNA virus (SeV), a paramyxovirus without a DNA-state, are widely used to generate induced pluripotent stem cells (iPSCs). Unlike DNA vectors, SeV cannot integrate into the genome of infected cells; paramyxoviruses replicate and transcribe exclusively in the cytoplasm. Furthermore, recombination events have never been observed among paramyxoviruses. Available SeV reprogramming vectors, however, are replication-competent and prolonged expression of reprogramming factors requires extended culture periods to completely eliminate virus RNA entirely. In this study, we aim at developing a new reprogramming system based on a formerly described replication deficient SeV vector (rdSeV; Bossow, 2012, OpenVirolJ). Based on this vector system, we have generated four reprogramming vectors (rdSeV-Sox2, rdSeV-Oct4, rdSeV-c-Myc, rdSeV-Klf4) and were able to achieve high production titers (up to 10^8 IFU/mL). Notably, qRT-PCR analysis of transduced CD34+ cells showed high transgene expression despite the fact that secondary transcription is disabled in our vector system. Expression was detectable as early as 12 hours post-transduction and persisted for at least 7 days. We are currently optimizing vector ratios and individual vector titers to achieve efficient reprogramming of somatic cells. In the long run, this system could be a safer alternative for the generation of clinically applicable iPSCs. On the practical side, it might facilitate reprogramming since no extended culture period is required and viral RNA is diluted earlier than in available systems.
2. Herstellung von patienten-bzw. krankheitsspezifischen iPS-Zelllinien
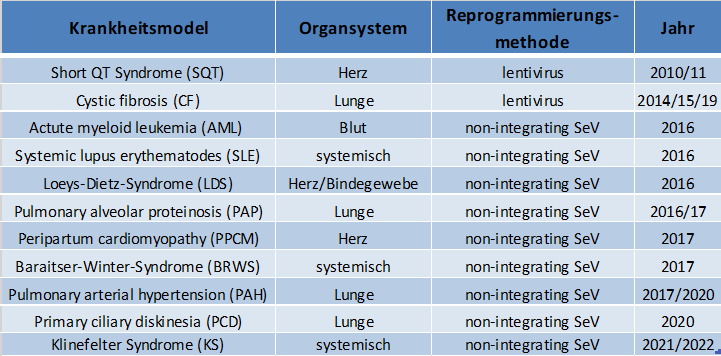
In der AG Martin wurden bisher iPS-Zellen aus Zellen der Maus, des Affen, des Menschen, aber auch verschiedener Primatenspezies (Javaneraffe, Gorilla, Bonobo) hergestellt. Verschiedene aus diesen Zellen hergestellte Zelltypen, wie Blutzellen, Endothelzellen und Epithelzellen u.a. wurden bzw. werden in der eigenen Arbeitsgruppe und von Kooperationspartnern zur Bearbeitung ganz unterschiedlicher Fragestellungen wie z.B. der Untersuchung der Hirnentwicklung verwendet.
Mittelerweile konnten in der Arbeitsgruppe eine Vielzahl von humanen patienten- bzw. krankheitsspezifischen iPS-Zellinien etabliert werden. Diese Sammlung von iPS-Zellinien wird ständig erweitert und steht für verschiedenste Forschungsprojekte und insbesondere für Untersuchungen der Pathomechanismen von verschiedenen Erkrankungen zur Verfügung.
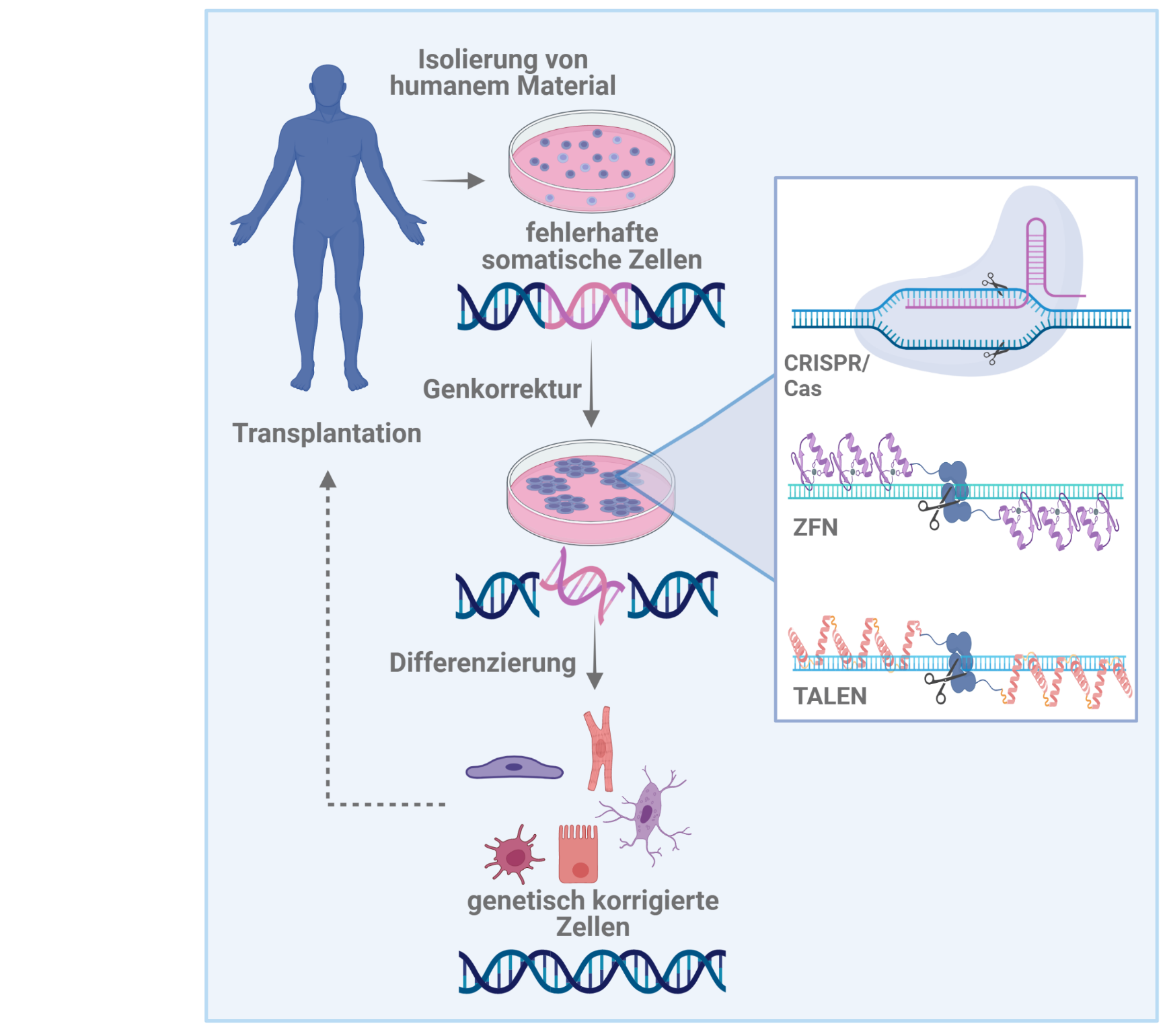
3. Gezielte genetische Modifikation von iPS- Zellen und daraus differenzierter Derivate
Viele kardiovaskuläre Erkrankungen z.B. des Herzens oder der Atemwege basieren auf genetischen Defekten bzw. Mutationen. Prinzipiell sind regenerative Therapien denkbar, bei denen patientenspezifische Zellen gewonnen und diese zu iPS-Zellen reprogrammiert werden, gefolgt von der genetischen Korrektur der Erkrankung. Genetische Modifikationen von Stammzellen erfolgten bisher meist unter Verwendung von zufällig integrierenden viralen Vektoren oder Plasmiden. Dies beherbergt jedoch das Risiko der Aktivierung benachbarter Allele einschließlich der von Protoonkogenen über insertionelle Mutagenese. In Hinblick auf zukünftige klinische Anwendungen von patientenspezifischen iPS-Zellen müssen daher alternative Genmodifikationsmethoden, die mit geringeren Risiken verbunden sind, zum Einsatz kommen.
Neuartige Technologien zur gezielten Veränderung des Genoms basieren auf der Verwendung von artifiziellen Enzymen, so genannten „Designer-Nukleasen“. Hierzu zählen Zink-Finger Nukleasen (ZFNs), „Transcription activator-like effector“-Nukleasen (TALENs) oder das CRISPR/Cas9 System. Diese Enzyme können zur Korrektur genetischer Defekte so gestaltet werden, dass sie in einem spezifischen genomischen Lokus einen DNA-Doppel/Einzelstrangbruch einfügen, was unter Zuhilfenahme zelleigener Reparaturmechanismen die gezielte Veränderung des Genoms erlaubt. Im Vergleich zum konventionellen „Gene targeting“ und der Verwendung integrierender Vektoren, ist die ZFN-, TALEN- bzw. CRISPR/Cas9-basierte homologe Rekombination damit nicht nur deutlich sicherer, sondern auch sehr viel effizienter. Zusammen mit der bahnbrechenden Entdeckung von iPS-Zellen könnte es damit möglich sein, für viele insbesondere genetisch bedingte Erkrankungen patientenspezifische Zelltherapien zu entwickeln.
Des Weiteren können mit Hilfe der ZFN- bzw. TALEN-Methode auch Genkonstrukte in die Zellen eingebracht werden, welche therapeutische Gene enthalten, um damit z.B. „suprafunktionelle“ Zellen herzustellen. Reporter- oder Selektionsgene unter Kontrolle geeigneter zelltypspezifischer Promotoren können ebenfalls exprimiert werden. Diese können nicht nur für die Optimierung der Kultur und Differenzierung pluripotenter Stammzellen, sondern auch für die Aufreinigung von aus Stammzellen differenzierten Zellen, z.B. Kardiomyozyten und Lungenepithel, von großem Nutzen sein.
Transgene Reporterzelllinen können darüber hinaus für das Screening von neuen Wirkstoffen zur Behandlung von diversen Erkrankungen genutzt werden. Für Reporterzelllinien, die in einem solchen Hochdurchsatzscreening Verwendung finden sollen, sind Designernukleasen ein wertvolles Werkzeug. So können vor allem transgene Reporterkonstrukte, welche ein automatisiertes Screening erleichtern, in krankheitsspezifische iPS-Zellen eingebracht werden.
4. Optimierte Steuerung von vaskulären und respiratorischen Differenzierungsvorgängen von iPS-Zellen zur Entwicklung von organotypischen in vitro Krankheitsmodellen
Eine möglichst effiziente in vitro Differenzierung ist für die Verwendung iPS-abgeleiteter Zellen der Lunge und der Blutgefäße in organotypischen Krankheitsmodellen und Screeningsystemen, genauso wie für Zell-basierte regenerative Therapien von enormer Bedeutung. Auch wenn bereits auf umfangreiche Informationen aus der Entwicklungsbiologie zugegriffen werden kann, ist die Steuerung der Differenzierungsvorgänge in komplexen Organen wie der Lunge bisher noch nicht ausreichend verstanden.
Für eine gezielte Differenzierung über sequentielle Inhibierung bzw. Aktivierung beteiligter Signalwege ist ein tiefergehendes Verständnis dieser Vorgänge jedoch zwingend notwendig.
Hier unterstützen auch moderne Hochdurchsatzsequenzierverfahren, insbesondere die Einzelzell-RNA-Sequenzierung, mit der aktivierte Signalwege und fehlgeleitete Subpopulationen identifiziert werden können.
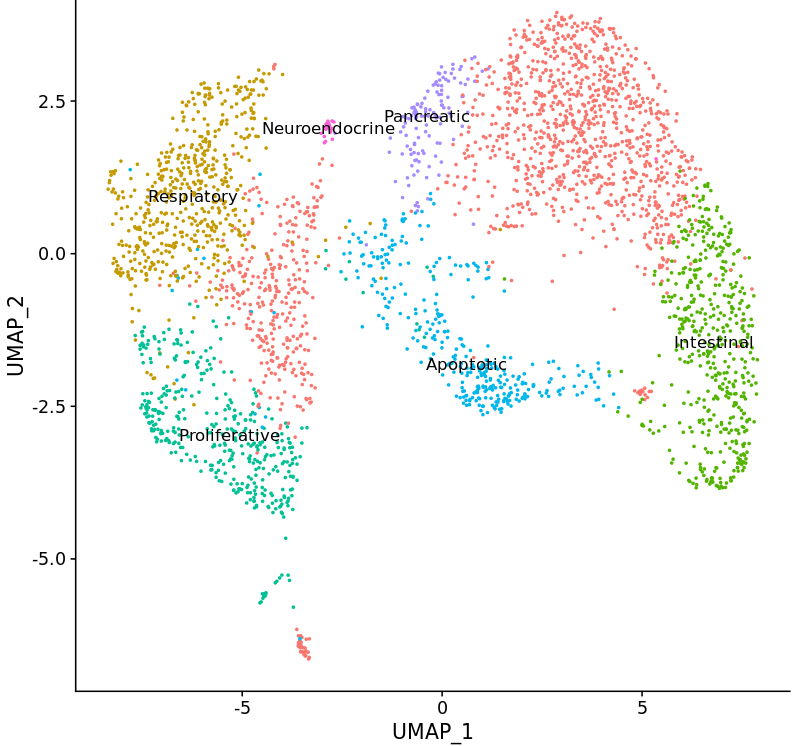
Application of single cell RNA sequencing to characterize transient cell populations and molecular signalling during respiratory differentiation of human pluripotent stem cells
Complex protocols have been developed to differentiate human induced pluripotent stem cells (hiPSC) via endoderm, foregut and NKX2.1pos early respiratory progenitor cells towards mature respiratory epithelia. However, these protocols reflect human development to a limited extent, efficiency and robustness of the protocols still need further improvement, and protocols have to be adapted for each individual cell line. At this point, it is not clear to what extent cell cycle characteristics and epigenetic features of individual lines play a role, and how paracrine factors released by contaminating cell lineages influence the differentiation outcome.
Therefore, further exploration of cellular composition and molecular signaling of the cells differentiated according to the established protocol are necessary to reveal contaminating cell types and potential signaling pathways to be targeted for the further improvement of the differentiation protocol.
hiPSCs were differentiated towards early respiratory progenitors according to the established protocol. Single cell RNA sequencing data analyses have been initiated from different stages of the differentiation protocol. Data obtained on day 12 of differentiation revealed not only lung progenitors (NKX2.1pos) as one major cell population, but in addition a second major discrete cell population identified as non-lung cells expressing CDX2 – a posterior endodermal and especially intestinal marker. Accordingly, differentiation cultures at endoderm / foregut endoderm stage have to be further manipulated to prevent formation of posterior foregut and midgut lineages.
Further analysis of different stages of the respiratory differentiation protocol is ongoing and resulting data will provide the ground for further protocol improvement via activation / inhibition of relevant signaling pathways
____________________________________________________________________________________________________________
In weiteren Studien untersuchen wir, wieso verschiedene aus iPS-Zellen als „juveniler“ Zellquelle hergestellte Zelltypen unerwarteterweise nur ein vergleichsweise geringes Vermehrungspotential aufweisen. So untersuchen wir aktuell das Phänomen der frühzeitigen Seneszenz von aus iPS-Zellen differenzierten Endothelzellen. Unser Ziel ist dabei, die Ursachen von vorzeitiger Seneszenz in iPS-derivaten zu identifizieren, um darauf basierend Differenzierungsprotokolle zu verbessern und letztendlich Zellkulturen mit hohem Vermehrungspotential für den Einsatz in Zellersatztherapien produzieren zu können.
Investigation of mechanisms underlying premature senescence in human iPSC-derived endothelial cells
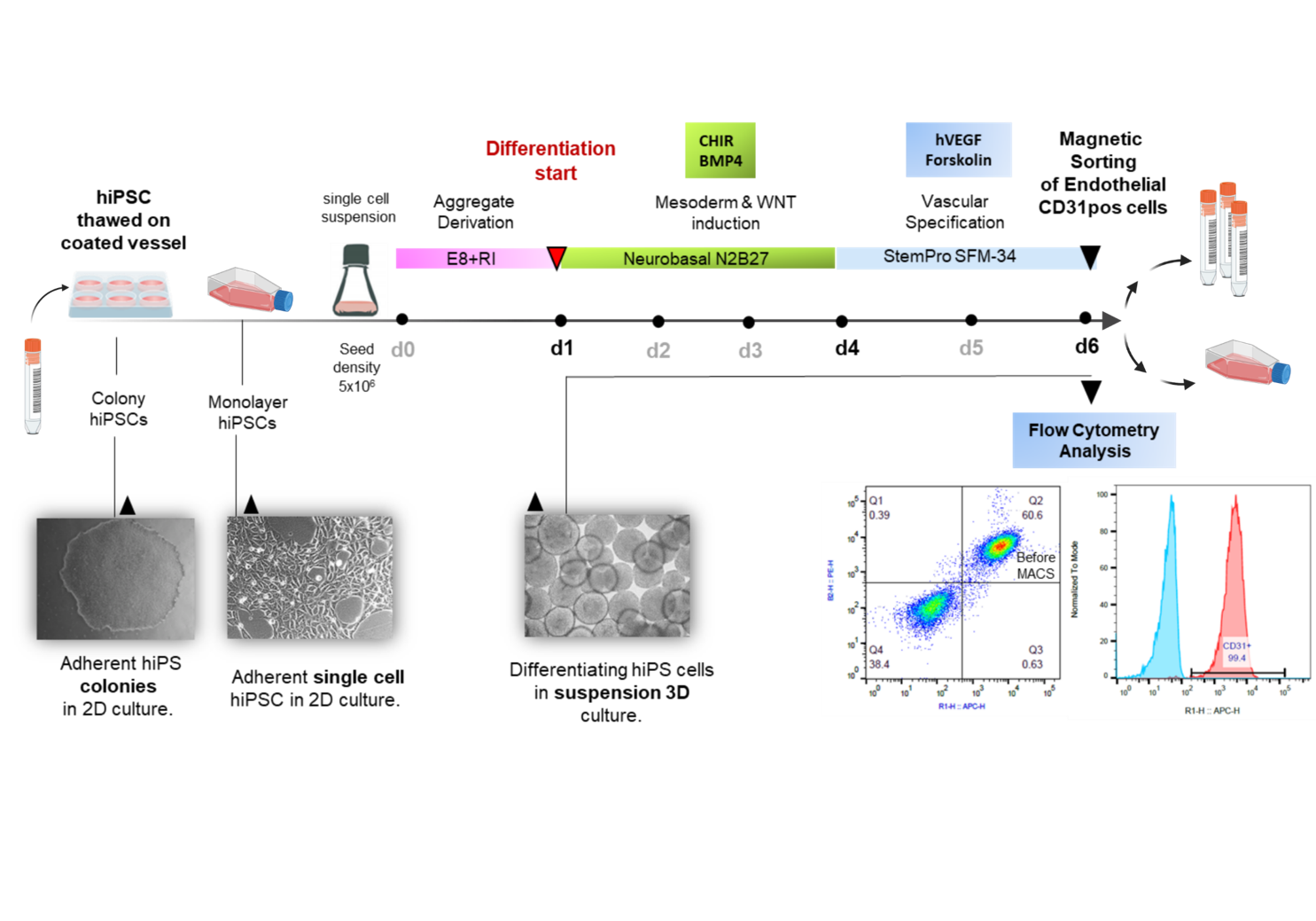
Induced pluripotent stem cells (iPSCs) are considered as potentially superior cell source for in vitro assays & cell therapies. Since protocols for differentiation and enrichment of specific cell lineages are typically still laborious and costly, the possibility to expand the resulting differentiated progeny would substantially facilitate the manufacturing process.
We and others have recently developed protocols for efficient production of highly enriched endothelial cells from hiPSCs (hiPS-ECs) that express common EC markers and display typical functionality. Contrary to their embryonic origin and to expectations, it is observed that hiPS-ECs differentiated from most lines show low population doublings with low expansion potential in comparison to primary human umbilical vein endothelial cells (HUVECs) or ECs obtained from adult individuals (HAOECs and HSVECs). The early senescence of iPSC derivatives has been observed in current protocols and the underlying reason has not yet been explained.
It is therefore the aim of our ongoing study to explore the underlying cause of the observed premature senescence in hiPSC-ECs for improving differentiation protocols and overcoming senescence for production of better proliferating ECs lacking senescence phenotype for use in cell therapy.
Our studies may represent the basis for improvement of current differentiation protocols yielding to differentiated hiPSC-derivatives with higher potential for culture expansion in future.
___________________________________________________________________________________________________________
Aus iPS-Zellen produzierte vaskuläre und respiratorische Zelltypen werden in der AG Martin sowohl für die Krankheitsmodellierung in in vitro Systemen als auch für das Screening nach neuen Wirkstoffen zur Therapie verschiedener Lungenerkrankungen verwendet.
So beschäftigen wir uns in der AG Martin u.a. mit der Entwicklung von Therapien zur Behandlung von Pulmonaler Hypertension, Primären Ziliopathien.

Auch die Mukoviszidose (Cystische Fibrose; CF) ist im Fokus unserer Forschung. Verursacht wird die Erkrankung durch Mutationen im so genannten „Cystic Fibrosis Transmembrane Conductance Regulator” (CFTR) Gen.
Da für verschiedene CF-Mutationen immer noch keine effektive Behandlung für CF verfügbar ist, arbeiten wir u.a. an der Entwicklung neuer Therapiekonzepte, bei denen alternative Ionenkanäle beeinflusst werden.
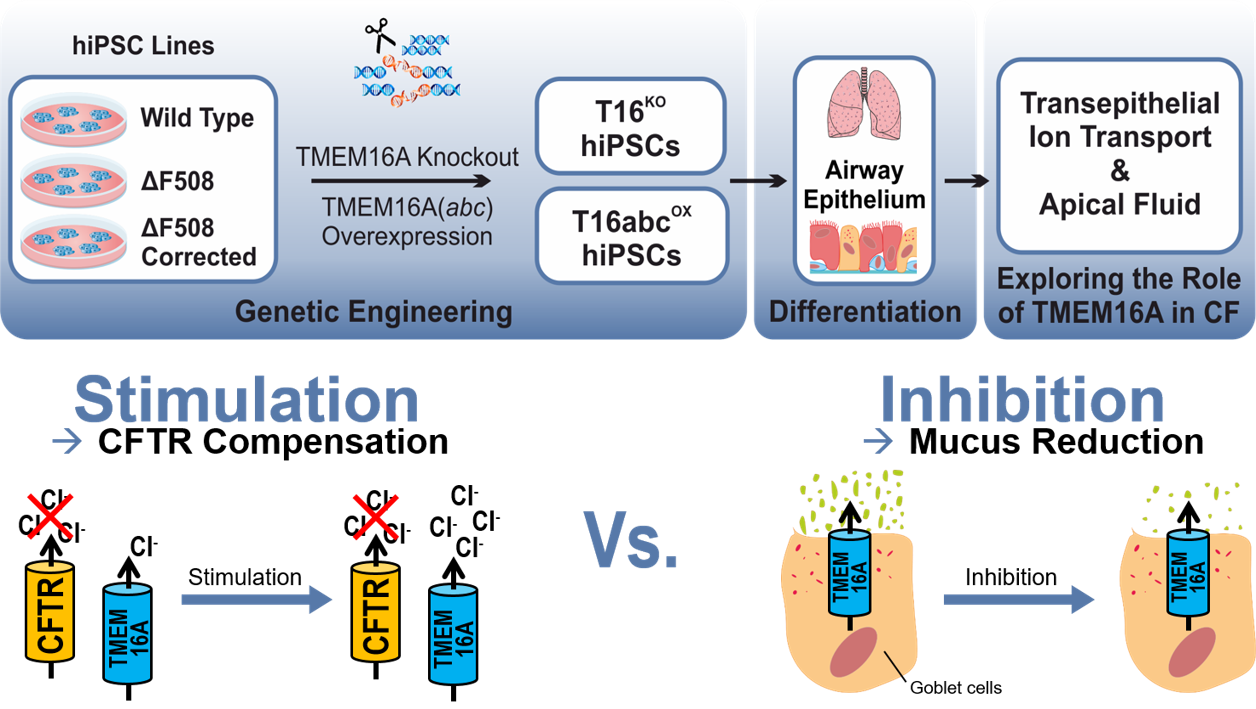
Evaluation of TMEM16A as a modifier for Cystic Fibrosis lung phenotype utilizing CF-patient specific human induced pluripotent stem cells
Cystic fibrosis (CF), also known as Mucoviscidosis, is a rare genetic disorder that causes the dysfunction of the chloride channel CFTR. In CF, the mutant CFTR leads to a disturbed chloride transport in the epithelial tissues of the human body and most severely affects the lungs. Here, the disturbed chloride secretion causes a dehydration of the airway mucus followed by chronic infection and inflammation that result in progressive loss of lung function. Although, CF therapy greatly advanced over the last decades, the effective therapy options for CF patients with rare CFTR mutation are mostly lacking. Previous studies have suggested that a co-expressed chloride channel known as TMEM16A may serve as a novel target in therapy of CF lung disease of all CF patients. However, it is still controversially debated whether the CF lung phenotype could be improved by stimulation of TMEM16A to induce mucus rehydration, or by inhibition of TMEM16A to reduce the mucus release. To resolve this issue, TMEM16A knockout (T16KO) as well as overexpressing (T16abcOX) hiPSCs were generated from multiple cell lines (wild type, CF patient-specific, gene corrected) and further differentiated into airway epithelial cells in air-liquid-interface (ALI) cultures. In close collaboration with the research group of Prof. Dr. Marcus Mall (Charité, Universitätsmedizin Berlin) functional studies are being conducted to measure the transepithelial ion conductance, ciliary beating and mucus properties in these transgenic hiPSC-derived airway epithelial cells. Our studies will create unique insights into the function of TMEM16A in CF and will hopefully provide conclusive findings about its utilisation in CF therapy. The project is funded by Mukoviszidose Institut GmbH
___________________________________________________________________________________________________________
Aus iPS-Zellen unter optimierten Differenzierungsprotokollen produzierte vaskuläre und respiratorische Zelltypen sollen langfristig auch für innovative Zellersatztherapien verwendet werden. Während patientenspezifische iPS-Zellen bereits hergestellt, charakterisiert und mit Hilfe der Designernukleasen genetisch modifiziert bzw. korrigiert werden konnten, und auch die anschließende Differenzierung der pluripotenten Zellen in (Vorläufer-) Zellen der Atemwege große Fortschritte gemacht hat, befinden sich effektive Applikationsformen zum Ersatz der körpereigenen mutierten Stammzellen der Atemwege allerdings noch am Anfang der Entwicklung.
5. Untersuchung zu Sicherheitsaspekten von Zelltherapien
Auch im Bereich der Sicherheitsforschung zu Zelltherapien wird in der AG Martin wichtige Entwicklungsarbeit geleistet.
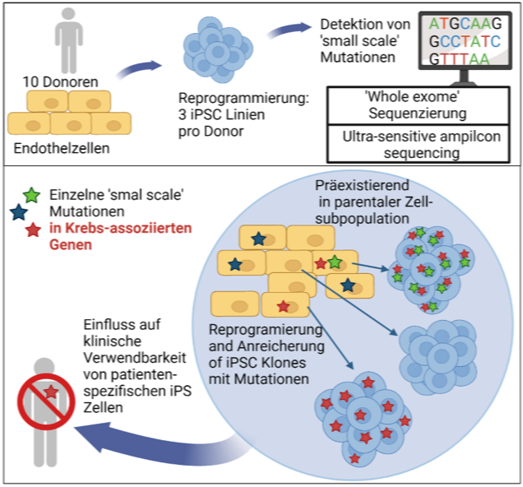
Unterdessen ist bekannt, dass iPS-Zellen eine nicht unerhebliche Zahl von kleinen Mutationen auf Nukleotidebene sowie z.T. auch größere genetischen Abnormalitäten tragen
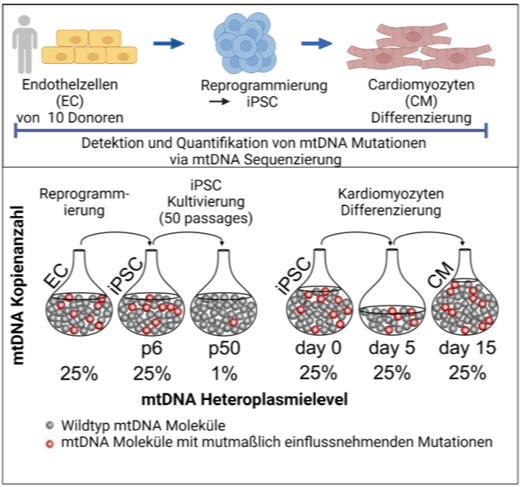
Wir konnten kürzlich zeigen, dass die Reprogrammierung somatischer Zellen zwar keine neuen Punkmutationen oder kleinere Deletionen generiert, es jedoch während Reprogrammierung und Zellexpansion zur Anreicherung von potentiell problematischen Mutationen im Kerngenom (Kosanke et al.,2021, MolTher) und im mitochondriellen Genom (Kosanke et al., 2021, Stem Cell Reports) kommen kann.
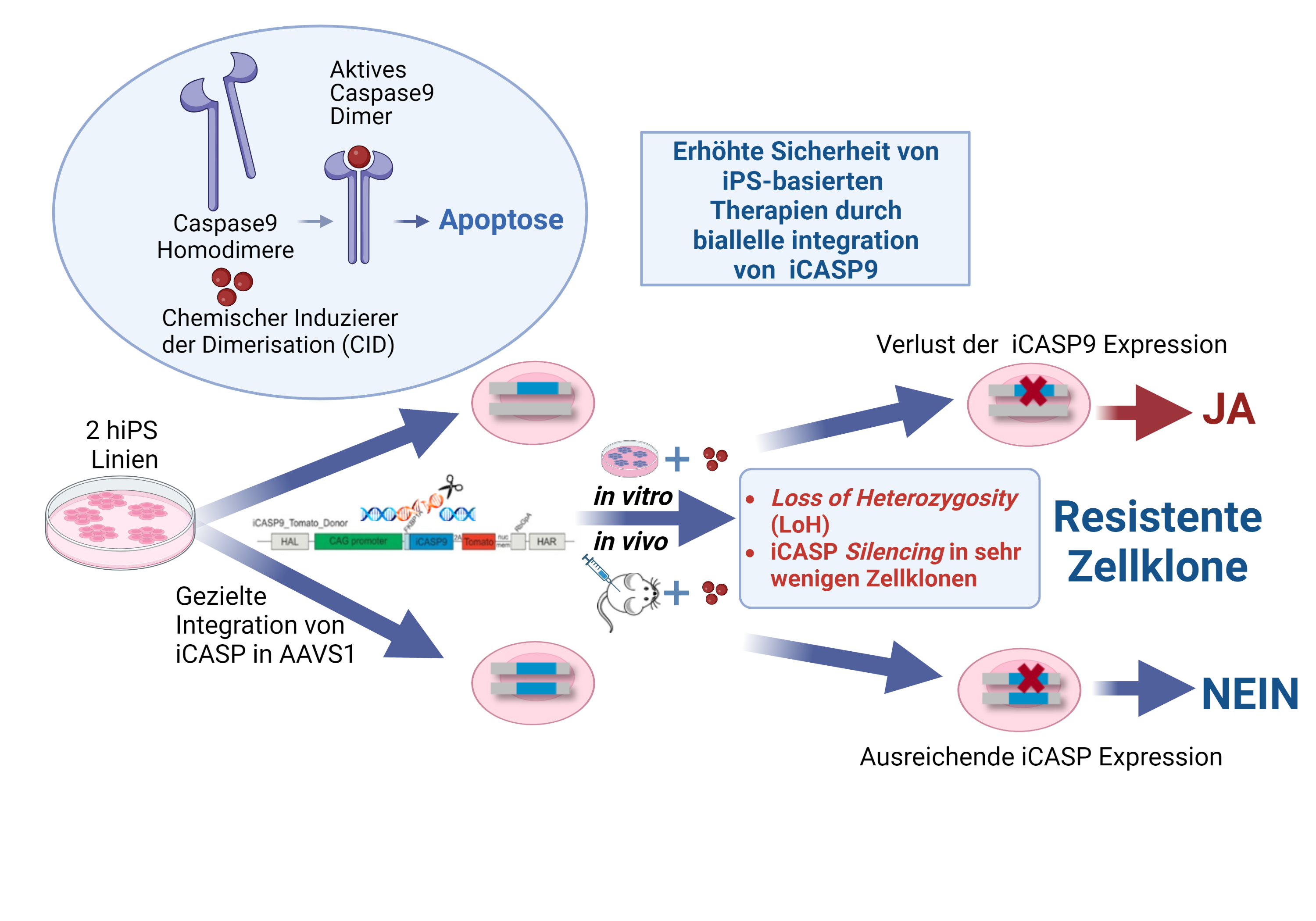
Um weitere Sicherheitsaspekte bei der Verwendung von iPS Zell-basierten Therapien zu adressieren, untersuchen wir die Anwendung von sogenannten Suizid Genen als induzierbare Sicherheitsschalter nach Einbringen in die Zellen über genetisches Engineering.
Mit Hilfe dieser Methode konnten wir zeigen, dass zwar schon die Integration einer Kopie des induzierbaren Caspase 9 Suicide Gens (iCASP9) in den AAVS1 Safe Harbour Genort die Apoptose der Zellen in vitro und in vivo effizient auslöst, jedoch erst die biallele Integration von zwei Kopien eines Suizid Gens die Entstehung sehr seltener Apoptose-resistenter Zellklone verhindert. Erst auf diese Weise kann das therapeutische Sicherheitslevel durch gezieltes Eliminieren von iPS Zellen und deren Derivate nach der Implantation erhöht werden (Wunderlich et al., 2022, Mol Ther Methods Clin Dev)
Referenzen:
- Kosanke M, Osetek K, Haase A, Wiehlmann L, Davenport C, Schwarzer A, Adams F, Kleppa MJ, Schambach A, Merkert S, Wunderlich S, Menke S, Dorda M, Martin U. Reprogramming enriches for somatic cell clones with small-scale mutations in cancer-associated genes. Mol Ther. 2021 Aug 4;29(8):2535-2553. doi: 10.1016/j.ymthe.2021.04.007. Epub 2021 Apr 6. PMID: 33831558; PMCID: PMC8353200.
- Kosanke M, Davenport C, Szepes M, Wiehlmann L, Kohrn Tim, Dorda M, Gruber J, Menge K, Sievert M, Melchert A, Gruh I, Göhring G, Martin U. iPSC culture expansion selects against putatively actionable mutations in the mitochondrial genome. Stem Cell Reports. 2021 Oct 16:2488-2502. doi: 10.1016/j.stemcr.2021.08.016
- Wunderlich S, Haase A, Merkert S, Jahn K, Deest M, Frieling H, Glage S, Korte W, Martens A, Kirschning A, Zeug A, Ponimaskin E, Göhring G, Ackermann M, Lachmann N, Moritz T, Zweigerdt R, Martin U. Targeted biallelic integration of an inducible Caspase 9 suicide gene in iPSCs for safer therapies. Mol Ther Methods Clin Dev. 2022 May 31;26:84-94. doi: 10.1016/j.omtm.2022.05.011. PMID: 35795779; PMCID: PMC9234009.
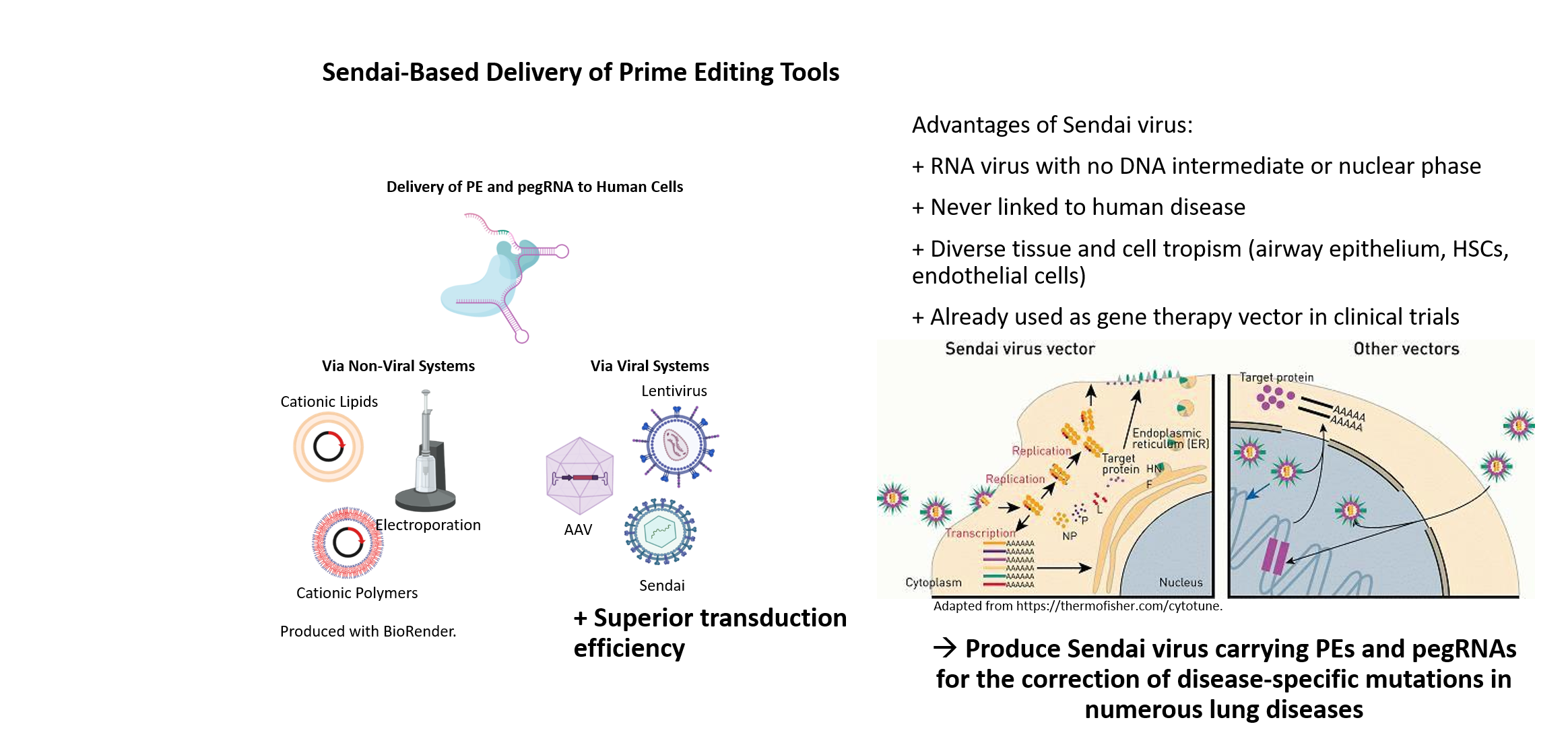
6. Entwicklung von Methoden zur in vivo Korrektur krankheitsspezifischer Mutationen über das „Gene Editing“
Ein großer Anteil von humanen genetischen Krankheiten wird durch Punktmutationen im Genom ausgelöst. Ein Ansatz zur gezielten Gentherapie durch Korrektur von krankheitsspezifischen Mutationen ist die CRISPR/Cas9-vermittelte Gen-Editierung anhand von präzisem und effizientem prime editing. Um die spezifische Behandlung von Patienten zu ermöglichen, ist die Entwicklung von innovativen Methoden zur effizienten in vivo Genkorrektur von besonderer Bedeutung. Die Entwicklung von sicheren und ausreichend effizienten Systemen zur Übertragung des CRISPR-Korrekturapparates in Patientenzellen ist essentiell für den Erfolg der Gen-Editierung in vivo. Deshalb beschäftigen wir uns in der AG Martin mit der Entwicklung neuer Methoden des in vivo Gentransfers, insbesondere der Etablierung eines neuen hocheffizienten und sicheren nicht-humanpathogenen, nicht-integrierenden Sendaivirus-basierten Vektorssystems zur Übertragung des CRISPR/Cas9-Gen-Editierung-Systems in vivo.
Sendai viral vectors for efficient prime editing and intravascular genetic repair of PAH disease-specific mutations
Site-directed nucleases are considered as major breakthrough in the development of regenerative therapies and biomedical research. With the advancement of ZFNs, TALENs and the CRISPR/Cas9 technology, straightforward and precise manipulation of the genome of human cells became possible. In contrast to ZFN- and TALEN-based methods, the power and attractiveness of the CRISPR/Cas9 system for biological research lies in the binding specificity of a simple Watson-Crick base pair matching between a short guide RNA and the DNA target sequence, directing the Cas9 endonuclease to cleave the DNA double strand. The specific recognition ability of CRISPR/Cas9 can also be employed for many other research applications. For instance, prime editing or base editing can be utilized to insert or correct point mutations, and a deactivated Cas9 (dCas9) can be fused to activators or repressors allowing for transcriptional regulation of distinct genes.
Although non-viral delivery systems for gene targeting in human iPSCs are quite efficient, viral delivery systems have clear advantages especially regarding in vivo targeting approaches. To exclude unwanted integration into the host genome, we have established a Sendai virus (SeV) system, an RNA virus with no DNA intermediate and no nuclear phase in its lifecycle. SeV has never been linked to human disease and readily infects many tissue and cell types including airway epithelium, hematopoietic stem cells, macrophages or endothelial cells. Besides its safety, SeV can accommodate and express foreign genes, which led to its application as gene therapy vector in clinical trials and as commercial vector for induction of pluripotency.
Our long term experience in TALEN- and CRISPR/Cas9-based genome engineering technology in combination with our induced pluripotent stem cell (iPSC) technologies will allow for the establishment of a SeV-based delivery of CRISPR/Cas9 for efficient gene editing in vivo, especially in respiratory and vascular cells. This will provide the basis for the development of new treatment options, in particular targeting lung diseases.