Projektvorstellung 2022
OTUB1-dependent regulation of cell death signaling determines the outcome of Listeria-infection and central nervous system autoimmunity
Josephine Koschel, Gopala Nishanth, Sissy Just, Kunjan Harit, Andrea Kröger, Martina Deckert, Michael Naumann, Dirk Schlüter
Die Regulation des Zelltodes von infizierten Zellen ist ein kritischer Parameter für den Verlauf von Infektionen. Der Zelltod wird durch verschiedene Signaltransduktionswege gesteuert. Dabei können unterschiedliche externe Stimuli Zelltod-Signalwege induzieren und wie im Fall von Tumor Nekrose Faktor (TNF) neben Zelltod durch Apoptose und Nekroptose auch zytoprotektive Signalwege aktivieren. Die Entscheidung über die Induktion von TNF-abhängiger Apoptose, Nekroptose oder Zelltod-inhibierendem NF-kB Signaling wird durch TNF-Rezeptor-assoziierte Signaltransduktionskomplexe gesteuert. In diesen Komplexen spielen posttranslationale Modifikationen durch Ubiquitinierungen und Deubiquitinierungen einzelner Signaltransduktionsmoleküle eine entscheidende Rolle.
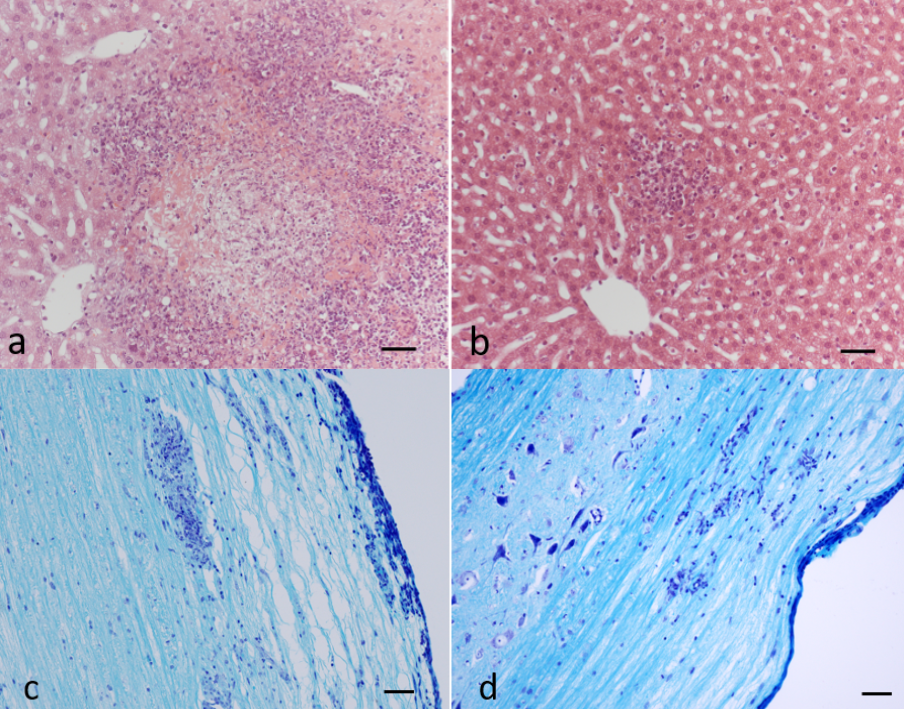
Im Forschungsbericht 2022 stellen wir ein Projekt der Arbeitsgruppe des Mikrobiologen Dirk Schlüter vor, welches aufdeckt, dass die Deubiquitinase OTUB1 die TNF-induzierte Nekroptose von humanen und murinen Hepatozyten bei einer Infektion mit dem Bakterium Listeria monocytogenes verhindert. Mechanistisch reduziert OTUB1 eine K48-Polyubiquitinierung des zellulären Inhibitors der Apoptose (c-IAP1) und dadurch seine Degradation. Bei Abwesenheit von OTUB1, kommt es zum proteasomalen Abbau von c-IAP1, was zu einer reduzierten K63-Polyubiquitinierung und vermehrten Phopshorylierung der RIP Kinase 1 (RIPK1) und der Bildung des RIPK1/RIPK3 Nekrosoms mit nachfolgendem Zelltod der Hepatozyten. Dieser Mechanismus des OTUB1-abhängigen Zelltodes von Hepatozyten trat nicht nur im murinen Modell der Listeriose, sondern auch nach Stimulation mit TNF ein, was die grundsätzliche Bedeutung von OTUB1 für die Regulation der TNF-abhängigen Nekroptose in Hepatozyten zeigt.
Induzierter Zelltod spielt auch bei Autoimmunerkrankungen eine wichtige Rolle und aktuelle Arbeiten des Schlüter Labors zeigen, dass OTUB1 bei einer experimentellen CD4+ T-Zell-vermittelten Autoimmunerkrankung des Zentralnervensystems (ZNS) den CD95-induzierten Zelltod autoimmuner CD4+ Zellen im ZNS verhindert. Diese fehlende Elimination intrazerebraler autoimmuner CD4+ T-Zellen führt zu einer Exazerbation und Persistenz der klinischen Symptome der Autoimmunerkrankung.
Zusammenfassend zeigen diese Untersuchungen, dass das komplexe und dynamische Zusammenspiel von Ubiquitinierung und Deubiquitinierung fundamentale Auswirkungen auf den Zelltod und einen entscheidenden Einfluss auf den Verlauf von Infektionen und Autoimmunerkrankungen hat.Um das therapeutische Potential dieser Mechanismen der Zelltodregulation nutzen zu können, sind weitere vertiefende Arbeiten notwendig, da diese Prozesse Zelltyp- und zum Teil auch krankheits-spezifisch reguliert werden.
Publikation
OTUB1 prevents lethal hepatocyte necroptosis through stabilization of c-IAP1 during murine liver inflammation
Koschel J, Nishanth G, Just S, Harit K, Kröger A, Deckert M, Naumann M, Schlüter D.
Weitere Informationen
Herausgeber:
Präsident der Medizinischen Hochschule Hannover
Herr Prof. Dr. med. Michael P. Manns
Forschungsdekan der Medizinischen Hochschule Hannover
Herr Prof. Dr. med. Frank M. Bengel
Bearbeitung und Ansprechpartner:
Berichtswesen, der Medizinischen Hochschule Hannover
Alica Wollmann
Telefon: 0511/ 532– 5578
E-Mail: wollmann.alica@mh-hannover.de
Gestaltung:
Digitale Medien, Medizinischen Hochschule Hannover
Telefon: 05 11/ 532– 2963
Online Umsetzung:
Forschungsdekanat, Medizinische Hochschule Hannover
Jan Tauwaldt
und
Berichtswesen, der Medizinischen Hochschule Hannover
Alica Wollmann
Telefon: 0511/ 532- 5578
Forschungsbericht 2022
Hier finden Sie den mit Hilfe des Forschungsinformationssystems (FIS) erstellten Forschungsbericht. Wie in den vergangenen Jahren möchten wir hier die Gelegenheit nutzen, explizit ein Projekt stellvertretend vorzustellen.
Forschungsinformationssystem (FIS)Hier finden Sie weitere Informationen zum Forschungsinformationssystem (FIS).
Hochschulbibliographie- Projektvorstellung 2022
- Projektvorstellung 2021
- Projektvorstellung 2020
- Projektvorstellung 2019
- Projektvorstellung 2018
- Projektvorstellung 2017
- Forschungsbericht 2016
- Forschungsbericht 2015
- Forschungsbericht 2014
- Forschungsbericht 2013
- Forschungsbericht 2012
- Forschungsbericht 2011
- Forschungsbericht 2010
- Forschungsbericht 2009
- Forschungsbericht 2008
- Forschungsbericht 2007